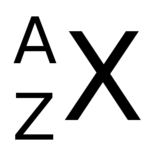The final launch of the Allmultimedia.org will take place on February 27, 2026
(shortly after the 2026 Winter Olympics).
Nukleonové číslo
Z Multimediaexpo.cz
Nukleonové číslo (též hmotnostní číslo, atomové hmotnostní číslo, hmotové číslo, symbol A, z německého slova Atomgewicht - atomová hmotnost) se rovná celkovému počtu nukleonů (tedy protonů a neutronů) v atomovém jádře daného nuklidu. Různé izotopy daného chemického prvku mají rozdílné nukleonové číslo.[pozn. 1]
Platí rovnice A=Z+N, neboť nukleonové číslo (A) je rovno součtu protonového (Z) a neutronového čísla (N).
Nukleonové číslo je přibližně rovné:
- atomové hmotnosti atomu (také izotopické hmotnosti atomu), která je vyjádřená v atomových hmotnostních jednotkách (také atomová hmotnostní konstanta, symbol mu = 1,661×10−27 kg). Atomová hmotnostní jednotka je ¹⁄₁₂ klidové hmotnosti atomu uhlíku-12 (prvku s 6 protony a 6 neutrony v jádře) v základním stavu a nevázaného chemickými vazbami,
- relativní atomové hmotnosti (Ar) daného jádra, což je bezrozměrná fyzikální veličina definovaná jako poměr průměrné hmotnosti atomů chemického prvku v daném vzorku k atomové hmotnostní jednotce.
- baryonovému číslu B jádra (a také celého atomu nebo iontu), protože protony a neutrony jsou baryony.
Obsah |
Zápis nukleonového čísla
Nukleonové číslo obvykle označujeme symbolem A. Zapisuje se buď za název prvku nebo jako horní index vlevo od symbolu prvku:
- Nejběžnější izotop uhlíku, který má 6 protonů a 6 neutronů, můžeme zapsat pomocí čísla za název prvku uhlík-12 nebo pomocí indexu 12C (také včetně protonového čísla 126C).
- Nejběžnější izotop uranu, který má 92 protonů a 146 neutronů, můžeme zapsat pomocí čísla za název prvku uran-238 nebo pomocí indexu 238U (také včetně protonového čísla 23892U).
V atomové a jaderné fyzice (v souladu s normami pro fyzikální veličiny a značky) je zvykem oddělovat nukleonové číslo mezerou, například uran 235.[1] V chemii je zvykem (v souladu s chemickými názvoslovnými normami) připojovat nukleonové číslo k názvu prvku spojovníkem, například uran-235.[2]
Související termíny
- Protonové číslo (Z) – je počet protonů (a tedy velikost kladného náboje) v jádře atomu. Je definující vlastností prvků. Protonové číslo se někdy nazývá atomové číslo.
- Neutronové číslo (N) – je počet neutronů v jádře atomu. Neutronovým číslem se liší různé izotopy jednoho prvku.
- Nuklid – látka složena z neutrálních atomů stejného druhu, přičemž všechny atomy mají shodné protonové číslo i nukleonové číslo (tedy počet protonů a neutronů v jádře).
- Izotop – nuklidy stejného prvku, které se liší počtem neutronů v jádře. Mají stejné protonové číslo, ale odlišné nukleonové číslo. Například uran s protonovým číslem Z = 92 má izotop uran-235 s nukleonovým číslem A = 235 a izotop uran-238 s nukleonovým číslem A = 238.
- Atomová hmotnostní konstanta (také atomová hmotnostní jednotka) – je ¹⁄₁₂ klidové hmotnosti atomu uhlíku-12 (prvku s 6 protony a 6 neutrony v jádře) v základním stavu a nevázaného chemickými vazbami. Symbol atomové hmotnostní konstanty je mu = 1,661×10−27 kg).
- Relativní atomová hmotnost (také atomová hmotnost, symbol Ar) – je podíl klidové hmotnosti daného atomu a atomové hmotnostní konstanty. Je to bezrozměrná veličina a pro jeden atom přibližně odpovídá nukleonovému číslu, tedy počtu nukleonů v jádře. U prvků v přírodě je dána poměrným zastoupením izotopů prvku.
Vztah nukleonového čísla a atomové hmotnosti prvku
- Nukleonové číslo atomu je součet protonů a neutronů v jeho jádře. Různé izotopy daného chemického prvku mají rozdílné nukleonové číslo. Je to celé číslo.
- Atomová hmotnost atomu (dříve atomová váha) udává odhad hmotnosti izotopů daného prvku měřené v atomových hmotnostních jednotkách (¹⁄₁₂ klidové hmotnosti atomu uhlíku-12, mu = 1,661×10−27 kg) v základním stavu a nevázaného chemickými vazbami. Není to obvykle celé číslo a je větší než nukleonové číslo.
- Rozdíl atomové hmotnosti atomu minus nukleonové číslo atomu se nazývá hmotnostní přebytek.
- Existují dva důvody pro hmotnostní přebytek:
- Neutron má hmotnost přibližně 1,008 a proton 1,007 atomové hmotnostní konstanty. To zvyšuje hmotnost jader s více neutrony a protony vzhledem k jednotkové stupnici založené na ¹⁄₁₂ 12C se stejným počtem protonů a neutronů.
- Jaderná vazebná energie se mezi jádry liší. Jádro s větší vazebnou energií má nižší celkovou energii, a tedy nižší hmotnost podle Einsteinova vztahu ekvivalence hmotnosti a energie E = mc2.
Poznámky
- ↑ U hyperjader se do nukleonového čísla započítává kromě protonů a neutronů i počet hyperonů. Příklad: 10ΛΛBe má 4 protony, 4 neutrony a 2 hyperony Λ, proto nukleonové číslo A=10.
Reference
- ↑ např. ČSN ISO 31-9 - Veličiny a jednotky. Část 9: Atomová a jaderná fyzika. Český normalizační institut, 1996, nebo předchozí, ale terminologicky podrobnější ČSN 01-1308 - Veličiny a jednotky v atomové a jaderné fyzice. Vydavatelství Úřadu pro normalizaci a měření, 1986
- ↑ např. IUPAC. Nomenclature of Inorganic Chemistry ("Red Book"). IUPAC Recommendations 2005. Příprava vydání Neil G. Connelly, Ture Damhus, Richard M. Hartshorn, Alan T. Hutton. [s.l.] : RSC Publishing, 2005. (IUPAC Nomenclature Books Series ("Color Books").) Dostupné online. ISBN 0-85404-438-8. Kapitola 3.3.1, s. 48. (anglicky)
Související články
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |