Multimediaexpo.cz je již 18 let na českém internetu !!
Glykosidy
Z Multimediaexpo.cz
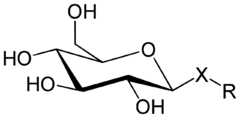
Glykosidy jsou deriváty sacharidů, vznikající náhradou hydroxylové poloacetalové (hemiacetalové) nebo poloketalové (hemiketalové) skupiny buď jiným cukerným nebo necukerným radikálem (zbytkem). V prvním případě z jednoho sacharidu vzniká oligosacharid vyššího stupně (z monosacharidu disacharid, z disacharidu trisacharid atd.). Někdy se tato skupina sloučenin označuje jako homoglykosidy (přednost se však dává pojmu oligosacharidy). Pokud se sacharid spojí s necukerným radikálem (zbytkem), tzv. aglykonem, vznikají glykosidy v užším slova smyslu, zvané někdy heteroglykosidy. Glykosidy vznikají zásadně od cyklických forem sacharidů, tvořících obvykle buď šestičlennou heterocyklickou formu (pyranosa) nebo pětičlennou cyklickou formu (furanosa); podle toho se vznikající glykosidy nazývají pyranosidy, resp. furanosidy. Konkrétní glykosidy se pak pojmenovají podle jména příslušného sacharidu; např. glykosidy vzniklé spojením glukosy s jiným radikálem se nazývají glukosidy (resp. glukopyranosidy), z ribosy ribosidy (resp. ribofuranosidy) atp. Je-li při substituci radikálem aglykonu, kterou glykosid vzniká, připojen tento radikál přes atom kyslíku, hovoříme O-glykosidech, je-li připojen atomem dusíku mluvíme o N-glykosidech (správněji glykosylaminech), analogicky při napojení přes atom síry se jedná o S-glykosidy. Vzhledem k tomu, že radikálem substituovaná poloacetálová hydroxyskupina může mít jednu ze dvou možných prostorových orientací, tato orientace se vyznačuje v názvu vzniklého glykosidu řeckými písmeny; rozeznáváme tak α-glykosidy a β-glykosidy. Prostorová stavba označovaná písmenem α odpovídá takové konfiguraci, ve které je poloacetálová hydroxyskupina orientována stejně, jako hydroxylová skupina na tzv. anomerním referenčním atomu; u pentos je to uhlíkový atom č. 4, u hexos uhlíkový atom č. 5. Vedle velmi významných v přírodě se vyskytujících homoglykosidů, tedy oligosacharidů, patří k nejvýznamnějším heterogyklosidům všechny nukleotidy, které spadají do skupiny β-ribofuranosidů (složek RNA) resp. β-deoxyribofuranosidů (složek DNA).
Obsah |
Nomenklatura glykosidů
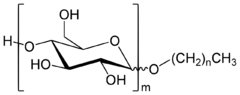
Systematické názvy heteroglykosidů se tvoří trojím možným způsobem:
- Za název cukerného nebo necukerného radikálu se připojí název výchozí cukerné složky s koncovkou osid; u heteroglykosidů se tento způsob používá zejména tehdy, kdy struktura aglykonu je jednodušší. Např. methyl-α-D-glukopyranosid.
- Uvede se v kulaté závorce název výchozí cukerné složky s koncovkou osyl následované názvem heteroatomu, jehož prostřednictvím se cukerná složka váže na aglykon, např. oxy, azo atp.; před závorkou se uvede případný lokant, označující místo substituce v necukerné složce, jejíž název se uvede za závorkou. Např. 4'-(β-D-glukopyranosyloxy)acetofenon.
- Uvede se symbol prvku, jehož prostřednictvím se cukerná složka váže na aglykon, případně doplněný lokantem v horním indexu, za nímž následuje v kulaté závorce název výchozí cukerné složky s koncovkou osyl; za závorkou následuje název necukerné složky. Např. O3-(β-D-xylopyranosyl)L-serin.
Při použití druhého a třetího způsobu v případech, kdy nemůže dojít k nejasnostem, se mohou kulaté závorky vypustit.
Štěpení glykosidů
Glykosidy se štěpí (hydrolyzují) pomocí zředěných minerálních kyselin nebo specifických enzymů, tzv. glykosidas. Podle typu štěpené glykosidické vazby rozlišujeme α-glykosidasy a β-glykosidasy. Thioglykosidy se štěpí enzymem myrosinasa (thioglukosidasa). Enzymy a glykosidy bývají v rostlině uložené odděleně a přijdou do styku až v případě porušení pletiva nebo následkem odumírání pletiva. Hydrolytický význam glykosidů ovlivňuje jejich farmakologickou účinnost - někdy jsou účinné pouze nerozštěpené glykosidy (např. v případě kardioaktivních glykosidů), jindy vznikají účinné látky až po rozštěpení glykosidu (např. v případě glukosinolátů). Množství glykosidů v rostlině značně kolísá a závisí na metabolismu, který v ní probíhá. Například po sklizni v rostlině převažují pochody dýchání a glykosidy jsou spíše rozkládány.
Syntéza glykosidů
Syntéza glykosidů zahrnuje jednak syntézu aglykonu, která je pro velkou rozmanitost aglykonů též dosti rozrůzněná, a glykosylaci aglykonu. Při ní hrají důležitou roli enzymy glykosyltransferasy, které umožňují přenos glykosylových zbytků. Dárcem glykosylu je aldosa-1-fosfát. Tvorba glykosidů má pro rostlinu zejména význam detoxikační, přičemž lipofilní toxické látky se po navázání cukru stávají rozpustnými ve vodě a mohou být snadno vyloučeny, obyčejně do buněčné šťávy vakuol, ale i do jiných částí rostlinné buňky. Glykosidy se vyskytují hojně v rostlinné říši, ale některé z nich mohou být syntetizovány i živočichy a mikroorganismy. Jak již bylo řečeno, hrají důležitou roli při detoxikaci ve vodě nerozpustných látek. Jinak mohou sloužit jako toxiny, odstrašující případné predátory, například cykasin v tropických cykasech. Ve farmakologii jsou hojně užívány, přičemž jejich účinek závisí hlavně na aglykonu, ale navázaný sacharid může jeho vlastnosti podporovat nebo potlačovat.
Členění glykosidů
Glykosidy tvoří pestrou skupinu látek. Pro představu vyjmenuji některé skupiny zástupců, roztříděné podle typu aglykonu:
- fenolové glykosidy
- glykosidy kumarinů a jejich derivátů
- flavonoidové glykosidy
- antokyanidinové glykosidy
- antrachinonové glykosidy
- kardioaktivní glykosidy
- saponiny
- kyanogenní glykosidy
- glukosinoláty (thioglykosidy)
- glykosidy s iridoidovým aglykonem.
Externí odkazy
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |