Foreground plně podporuje – RWD, HTML 5.0, Super Galerii a YouTube 2.0 !
Voda
Z Multimediaexpo.cz
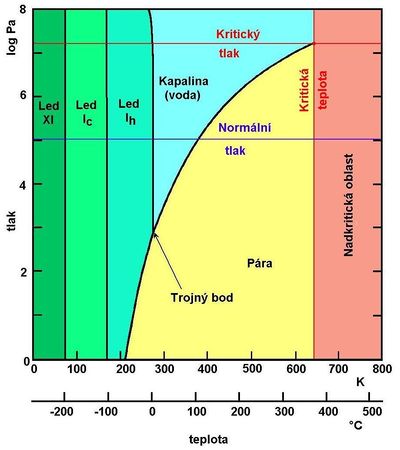
Voda, sumárním vzorcem H2O, systematicky oxidan [1], je chemická sloučenina vodíku a kyslíku. Spolu se vzduchem, resp. zemskou atmosférou tvoří základní podmínky pro existenci života na Zemi. Za normální teploty a tlaku je to bezbarvá, čirá kapalina bez zápachu, v silnější vrstvě namodralá. V přírodě se vyskytuje ve třech skupenstvích: v pevném – led a sníh, v kapalném – voda a v plynném – vodní pára.
Systematicky se nazývá „oxidan“. Častokrát se i v odborné literatuře označuje jako „dihydrogenmonooxid“ či „oxid vodný“, nebo dokonce jako „kyselina hydroxylová“. Všechny tyto tři názvy jsou ale chybné: nejedná se ani o oxid, ani o kyselinu, ale o anorganický[2] jednojaderný hydrid[3] (proto končí na příponu „-an“[4]). Název oxidan byl užíván již dříve, ale byl to název triviální, systematickým byl ustanoven až od názvosloví IUPAC 93.[5] Kromě toho se užívalo a užívá i triviální označení „voda“. Pojem voda se ale používá i jako označení pro směs, jejímž hlavním základem je právě sloučenina oxidan (vizte článek Voda). Někdy se oxidan označuje i termínem „destilovaná voda“, ale ani to není správné, protože destilovaná voda je jen jedním druhem oxidanu (oxidanu získaném destilací).
Podle počtu neutronů v atomu vodíku rozlišujeme
- lehkou vodu (oba vodíky jsou protia, strukturní vzorec je 1H2O),
- polotěžkou vodu (jeden vodík je protium a jeden deuterium, strukturní vzorec se dá zapsat jako HDO),
- těžkou vodu (oba vodíky jsou deuteria, strukturní vzorec je 2H2O, ale dá se také zapsat jako D2O; voda vyrobená z těžkých atomů vodíku, v přírodě se nachází zcela běžně ve směsi s normální vodou v nízké koncentraci, těžká voda sloužila ke konstrukci prvních atomových reaktorů) a
- tritiovou vodu (zvána též supertěžká voda, oba vodíky jsou tritia, strukturní vzorec je 3H2O, ale dá se zapsat i jako T2O).
Obsah |
Rozdělení vody
Vyskytuje se ve třech skupenstvích.
- podle skupenství
- pevné – led, sníh
- kapalné – voda, (přechlazená voda)
- plynné – vodní pára
- podle hydrologie a meteorologie:
- povrchová
- voda v oceánech (většinou slaná), např. mořská voda
- voda v ledovcích (sladká, v pevném skupenství)
- podle umístění
- voda v řekách, potocích a potůčkách (většinou sladká; vždy tekoucí)
- voda v jezerech (někdy slaná, někdy sladká; někdy tekoucí, někdy stojatá)
- podle stojatosti
- ostatní povrchová voda
- podpovrchová
- voda v atmosféře – ve formě páry nebo ve formě srážek
- povrchová
- podle tvrdosti
- podle salinity (slanosti)
- podle mikrobiologie
- pitná voda – je vhodná ke každodennímu použití, je zbavená nečistot, obsahuje vyvážené množství minerálních látek tak, aby neškodily zdraví, např. minerální voda (obsahuje mnoho minerálních látek), může to být i balená voda
- užitková voda – v průmyslových závodech (sníží se tvrdost vody a ta se zbaví Fe2+ a Mn2+) a v potravinářství – vyžaduje dezinfikovanou vodu (chlórování, ozonizace, ozařování ultrafialovým zářením), např. napájecí voda (voda pro parní kotle, zbavená minerálních solí, aby nevznikl kotelní kámen, který zanáší potrubí, nebo voda určená k napojení zvířat /má odlišné parametry než voda pitná/ )
- odpadní voda, např. splašková voda
- podle obsahu živin (dusík, fosfor, popřípadě i přítomnost draslíku a mikrobiogenních prvků)
- ultraoligotrofní vody (velmi slabě úživné až neúživné vody)
- oligotrofní vody (slabě úživné)
- dystrofní vody – obsahují velké množství huminových kyselin (může být obsahem dalších živin řazena mezi oligotrofní nebo mezotrofní, potom se ale už nejedná o dystrofní vodu)
- mesotrofní vody (středně úživné)
- eutrofní vody (silně úživné)
- polytrofní vody (velmi silně úživné)
- hypertrofní vody (vysoce úživné)
- podle přírodní medicíny
- v náboženství
- pseudovědecké druhy vody
Chemické a fyzikální vlastnosti
Voda vzniká prudkým až explozivním slučováním vodíku s kyslíkem (hořením bezbarvým plamenem) podle rovnice:
- 2H2 + O2 → 2H2O,
za vývinu velkého množství tepla (exotermní reakce). Kromě toho vzniká jako vedlejší produkt vedle solí při neutralizaci kyselin zásadami, např.
- HCl + NaOH → H2O + NaCl.
Voda je obsažena ve spalných plynech při hoření většiny organických látek, např. methanu
- CH4 + 2O2 → 2H2O + CO2,
nebo oktanu (hlavní složky benzínu)
- 2C8H18 + 25O2 → 18H2O + 16CO2.
Vodné roztoky mohou vykazovat kyselou, neutrální nebo zásaditou reakci. Kyselost (acidita) a zásaditost (bazicita) se vyjadřuje ve stupnici hodnot pH. Rozsah stupnice je od 0 do 14 pH, přičemž hodnotě pH 7 odpovídá roztok neutrální. Hodnoty nižší označují roztok kyselý, hodnoty vyšší zásaditý čili alkalický. Vody kyselé jsou obvykle bez života, protože se v nich nevytváří plankton ani baktérie.
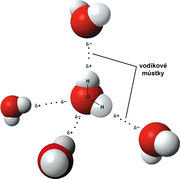
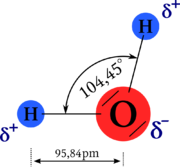
Mimořádné chemické a fyzikální vlastnosti vody jsou důsledkem geometrie její molekuly. Atomy v ní vázané nejsou uspořádány lineárně (v jedné přímce), ale chemické vazby mezi atomy svírají úhel přibližně 105 °. Polaritě vazeb (různé afinitě atomů vodíku a kyslíku) a zmíněné nelinearitě molekuly vděčí molekula vody za svoji polaritu, za existenci vodíkové vazby (zvané též vodíkové můstky) a anomálie následujících vlastností:
- hustota – Největší hustotu nemá led, ale tekutá voda při 3,95 °C. Je to způsobeno polymerizací vodních molekul v závislosti na teplotní změně úhlu mezi atomy vodíku. Nejmenší objem má proto při 3,95 °C a dalším snižováním teploty se objem zase zvětšuje. Krystalová struktura ledu má okolo 10 % „děr“ (ledovce „vystrkují“ toto procento objemu nad hladinu, zatímco 90 % skrývají). Voda o teplotě kolem 4 °C se hromadí na dně oceánu a vodních nádrží. Tato zvláštnost má např. tyto důsledky:
- – led se tvoří na povrchu vodních ploch a tím nezmrzlou vodu izoluje, voda tolik nepromrzá do hloubky, přičemž voda o teplotě 3,95 °C se hromadí na dně vodních ploch. Tato skutečnost je velmi důležitá pro přežití vodních organismů.
- – tento proces urychluje zvětrávání – voda zvětšující svůj objem „trhá“ horniny a další látky
- – zvětšování objemu má význam pro rostliny a zemědělství – při mrznutí dochází ke kypření ornice
Tepelná roztažnost vody bude (podle modelu změn klimatu) hlavní příčinou zvýšení mořské hladiny během 21. století v důsledku globálního oteplování[6].
- měrná tepelná kapacita (specifické teplo) – je třikrát větší než u většiny ostatních látek, jako jsou horniny, železo, hliník, atd. Proto má voda svou tepelnou setrvačností velký klimatický vliv a s výhodou se používá k transportu tepla (např. ústřední topení).
- specifická skupenská tepla (tání a varu) – V tomto parametru je voda naprosto neobvyklá. Vysoké výparné teplo umožňuje efektivní ochlazování teplokrevných obratlovců, jako je člověk – bez pocení by nepřežili.
- bod varu - Obecný trend v periodické tabulce prvků je takový, že s rostoucí hmotností se zvyšuje teplota varu. Nicméně vodíkové můstky nám dokazují, že mají vetší vliv na teplotu varu než hmotnost dané látky, a že voda a všechny sloučeniny s vodíkem v druhé periodě - B2H6, CH4, NH3 a HF - jsou výjimkou v tomto trendu.
| bod varu | |
|---|---|
| sloučenina | teplota |
| H2O | 100 °C |
| H2S | -60,28 °C |
| H2Se | -41,25 °C |
| H2Te | -2 °C |
| H2Po | n/a |
Právě díky vysoké měrné tepelné kapacitě je voda často využívána pro transport tepla. Zajímavá je také závislost hustoty vody na její teplotě: nejvyšší hustotu má při přibližně 4 °C, což způsobuje například to, že u dna hlubokých nádrží má právě tuto teplotu.
Chemicky čistá voda (destilovaná voda či deionizovaná voda) je elektricky nevodivá, ale i malé množství rozpustných příměsí způsobuje její vodivost.
Mpembův jev: teplá voda paradoxně mrzne (mění skupenství z kapalného na tuhé) dřív než studená (k jevu nemusí dojít vždy).
Termodynamika
| termodynamika | ||
|---|---|---|
| molární slučovací enthalpie | ΔfH0g | -241,83 kJ/mol |
| ΔfH0l | -285,83 kJ/mol | |
| ΔfH0s | -291,8 kJ/mol | |
| molární entropie na Kelvin | S0g, 0,1 MPa | 188,84 J/(mol.K) |
| S0l, 0,1 MPa | 69,95 J/(mol.K) | |
| S0s | 41 J/(mol.K) | |
| Dolní indexy: f - slučování; g - plyn; l - kapalina; s - pevná látka; horní index: 0 - standardní | ||
Povrchové napětí a viskozita
| povrchové napětí a viskozita | ||
|---|---|---|
| teplota °C | povrchové napětí mN/m | viskozita mPa·s |
| 0 | 75,6 | 1,78 |
| 10 | 74,2 | 1,31 |
| 20 | 72,8 | 1,00 |
| 30 | 71,2 | 0,80 |
| 50 | 67,9 | 0,55 |
| 100 | 58,9 | 0,28 |
Tepelná vodivost
| tepelná vodivost | |
|---|---|
| teplota ve °C | tepelná vodivost ve W/(m.K) |
| -20 | kapalina: 0,523, led: 2,43 |
| 0 | kapalina: 0,564, led: 2,22 |
| 10 | 0,584 |
| 20 | 0,597 |
| 30 | 0,618 |
| 50 | 0,645 |
| 80 | 0,670 |
| 100 | 0,682 |
Tvrdost vody
Veličina nejčastěji udávající koncentraci kationtů vápníku a hořčíku ve vodě. Definice tvrdosti vody je však nejednotná, někdy se tak označuje koncentrace dvojmocných kationtů vápníku, hořčíku, stroncia a barya, nebo všech kationtů s nábojem větším než jedna. Vzhledem k této nejednotnosti se moderní hydrochemie termínu tvrdost vody snaží vyhýbat. V praxi mnoha oborů, například akvaristiky, se však pojem tvrdost vody stále často užívá.
Celkovou tvrdost můžeme rozdělit na přechodnou, tj. uhličitanovou a na stálou. Přechodnou (karbonátovou) tvrdost vody způsobují rozpustné hydrogenuhličitany a to především hydrogenuhličitan vápenatý Ca(HCO3)2 a hydrogenuhličitan hořečnatý Mg(HCO3)2; tuto tvrdost vody lze odstranit převařením – dekarbonizací:
- Ca(HCO3)2 → CaCO3 + H2O + CO2
- Mg(HCO3)2 → MgCO3 + H2O + CO2.
Vařením se však nezbavíme tvrdosti trvalé (nekarbonátové), za kterou jsou odpovědné především sírany, a to síran vápenatý CaSO4 a síran hořečnatý MgSO4. K jejich odstranění používáme srážení působením hydroxidu vápenatého Ca(OH)2 a uhličitanu sodného Na2CO3:
- Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
- Mg(HCO3)2 + Ca(OH)2 → CaCO3 + MgCO3 + 2 H2O
- MgSO4 + Ca(OH)2 → CaSO4 + Mg(OH)2
- CaSO4 + Na2CO3 → CaCO3 + Na2SO4,
čímž se rozpustné hydrogenuhličitany a sírany převedou na méně rozpustné normální uhličitany, a to uhličitan vápenatý a uhličitan hořečnatý, resp. hydroxid hořečnatý.
Hodnotu tvrdosti vody uvádíme v mmol/l nebo tzv. německých stupních tvrdosti (dGH). Jeden německý stupeň odpovídá 10 mg CaO v jednom litru vody. Současná (2005) česká norma stanovuje tvrdost vody podle koncentrace Ca a Mg (mmol/l). Mezi uvedenými jednotkami je možno přibližně převádět podle vztahu 1 mmol/l = 5,61°dGH.
Z celkové tvrdosti vody jsou odvozeny tyto údaje: tvrdost od 1 do 10° značí vodu měkkou, z toho do 5° jde o vodu zvláště měkkou. 10–20° značí střední tvrdost, 20–30° značí vodu tvrdou a přes 30° zvláště tvrdou.
Voda v přírodě
Rozšířením vody na Zemi a jejím pohybem se zabývá hydrologie.
Výskyt vody na naší planetě je mnohem vyšší než na ostatních planetách sluneční soustavy. Při pohledu z vesmíru vypadá Země jako modrobílá planeta: bílá od vodní páry a modrá od vody. A zákonitě všechny formy života (tak jak ho známe) závisejí na vodě. Část zemského povrchu s obsahem vody v kapalném skupenství nazýváme hydrosféra.
Většinu povrchu Země (71 %) pokrývá slaná voda moří a oceánů, jež tvoří 97 % celého vodstva na naší planetě. Obsahuje průměrně 35 g solí v jednom litru. Z toho 77,8 % chloridu sodného (NaCl), 10,9 % chloridu hořečnatého (MgCl2) a další soli jako síran hořečnatý, síran vápenatý, síran draselný a jiné.
Sladká voda tvoří jen nepatrnou část hydrosféry - 3 %, přičemž 69 % této vody je v ledovcích, které jsou v polárních oblastech. Dalších 30 % je voda podzemní a jen necelé procento tvoří voda povrchová a atmosférická.
| Forma | množství (mil. km3) | procent z celku |
|---|---|---|
| Moře a oceány | 1 370 | 97,25 % |
| Ledovce | 29 | 2,05 % |
| Spodní voda | 0,5 | 0,68 % |
| Jezera | 0,125 | 0,01 % |
| Půdní vlhkost | 0,065 | 0,005 |
| V atmosféře | 0,018 | 0,001 |
| Řeky | 0,0017 | 0,0001 % |
| Biosféra | 0,0006 | 0,000004 % |
| Celkem[7] | 1 409 | 100 % |
Koloběh vody na kontinentech začíná srážkami. Jakmile dopadnou z mraků na povrch, mohou putovat třemi cestami:
- zpravidla víc než 50 % (někdy i 100 %) se znovu vypaří
- méně než 30%, většinou 10 % - 20 %, steče do potoků, řek a nakonec do moře
- 10 % a méně (ale také nic) se může vsáknout.
Množství kyslíku rozpuštěného ve vodě nepřesahuje maximální koncentraci 14 mg kyslíku na litr vody při teplotě 4 °C, s rostoucí teplotou pak množství kyslíku klesá a tak voda o teplotě například 20 °C obsahuje pouze 9 mg kyslíku na litr.
Výskyt vody ve vesmíru
Ve vesmíru se velké množství vody nachází v molekulárních mračnech v mezihvězdném prostoru. Také protoplanetární mlhovina, ze které vzniklo Slunce a celá sluneční soustava, obsahovala velké množství vody, z níž část se zachovala v Oortově oblaku, kde se z ní zřejmě ještě dnes tvoří nové komety. Jádra komet obsahují desítky procent vody. Podle jedné z teorií právě komety zanesly na Zemi většinu vody, která zde v současnosti je.
Také některé měsíce planet, tělesa Kuiperova pásu a transneptunická tělesa jsou převážně tvořena vodou v pevném skupenství. Velký podpovrchový oceán vody se předpokládá na Jupiterově měsíci Europa.
V červenci 2007 bylo oznámeno (viz [1]), že se voda v plynném skupenství nachází i na extrasolární planetě — konkrétně na planetě HD 189733b, nacházející se 63 světelných let od Země v souhvězdí Lištičky.
- plynná (vodní pára)
- kapalná:
- zmrzlá voda (led)
- Mars – výskyt potvrdila na pólech orbitální sonda Mars Express
- Pluto – odhad, že led tvoří asi 30 % Pluta
- Europa (měsíc planety Jupiter) – na povrchu je led
- Phoebe (měsíc planety Saturn) – předpoklad podle hustoty
- Enceladus (měsíc planety Saturn) – velmi pravděpodobný předpoklad
- komety – předpoklad
- okraje mlhovin, např. v Oortově oblaku – předpoklad
- není vůbec:
Význam a použití
- Je základní podmínkou života. Ve vodě vznikl život. Je to rozpouštědlo, ve kterém probíhají veškeré chemické děje v organismu. Lidské tělo obsahuje 70 % a rostliny až 90 % vody. Už ztráta 20 % tělesné vody je smrtelná. Na dehydrataci člověk umírá asi během 7 dnů. (Podle Guinnesovy knihy rekordů vydržel bez vody nejdéle jeden mladý Rakušan, kterého policie zapomněla v cele pro zadržené. Našla ho po 18 dnech na prahu smrti.)
- Je nejdůležitější surovinou všech průmyslových odvětví, používá se ke chlazení, ohřevu, oplachu, k výrobě elektrické energie ve formě páry a v potravinářství k výrobě nápojů atd.
- Je základní podmínkou rostlinné a živočišné výroby
- Je zdrojem obživy v přímořských státech
- Vodní toky (řeky) a plochy (oceány, moře, jezera) hrají významnou roli v dopravě.
- Přítomnost vodních ploch má vliv na klima krajiny.
- Voda je využívána při rekreaci a sportu.
- Minerální voda má léčivé účinky.
Obsah vody v některých potravinách:
- máslo 18 %
- chléb 40 %
- sýr 30 až 60 %
- jogurt, mléko 87,5 %
- maso 60-75 %
- jablko, hruška 85 %
- vodní meloun 90 %
- mrkev 94 %
- okurky, rajčata 98 %
viz také: obsah vody v měkkýších
Vodní hospodářství
Vodní hospodářství obecně zajišťuje dodávky pitné vody (vodní zdroj, vodárna, vodojem, vodovod, vodovodní přípojka) pro domácnosti i průmysl a nakládá s odpadními vodami. Provádí odběr, transport (stoková síť neboli kanalizace) a čištění odpadních vod v čistírnách odpadních vod. Předchází znečištění vody.
Pitná voda
Pitná voda se získává úpravou surové vody. Surová voda se získává z podzemních nebo povrchových zdrojů. Z některých zdrojů – zejména podpovrchových – je možné získat pitnou vodu bez úpravy.
- Ke shromažďování povrchové vody slouží vodárenská nádrž (přehrada), v níž se nachází odběrová věž s několika odběrovými šachtami v různých hloubkách. Odebírá se podle příkazu z úpravny vody, která bývá v blízkosti přehrady. Vhodná teplota pro odběr je méně než 12 °C.
- Výjimečně se využívá umělé filtrace a sorpční schopnosti půdního sedimentu, protože řasy často ucpávají filtraci. Voda z toku se nechá infiltrovat z umělých nádrží do podzemí a z podzemí se poté čerpá. Příkladem může být vodárna v obci Káraný, která od r. 1911 vyrábí kvalitní pitnou vodu pro přibližně třetinu Prahy a řadu dalších obcí a měst Středočeského kraje.
- Čerpání z podpovrchových zdrojů z podzemních vrtů.
Surová voda se odvádí do úpravny vod. Tam se upravuje (mechanické předčištění, chemické čeření, filtrace přes pískové filtry, odstranění iontů železa a manganu, někdy i částečné odstranění dusičnanů a dusitanů, dezinfekce). Pak směřuje do vodojemů a z nich se vodovody dopravuje k spotřebitelům.
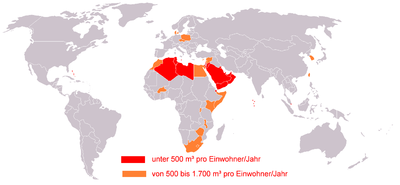
K pitné vodě v současnosti (2006) nemá přístup více než 1 miliarda lidí. Proto je zajištění přístupu k pitné vodě jedním z cílů usnesení OSN Rozvojové cíle tisíciletí.
Balená voda
Výroba a prodej balených vod má v Čechách dlouhou tradici, kterou můžeme vystopovat až do 16. století. Původně šlo výhradně o vody léčivé (ať už se skutečným nebo domnělým účinkem), stáčené do kameninových džbánků. K nim se později (18. - 19. století) přidaly i vody, které byly pro svou zvláštní chuť považovány za osvěžující nápoj. Jednalo se buď o minerální vody nebo o vody s vysokým obsahem oxidu uhličitého CO2, ať původu přirozeného (kyselky) nebo uměle připravované, stáčené převážně do skla. Tento stav se v Evropě v podstatě udržel do 60.-70. let minulého století, kdy jednak skleněné obaly začaly být postupně vytlačovány plastickými a jednak došlo ještě k jiné, mnohem revolučnější změně: balené vody začaly být používány též jako zdroj „obyčejné“ pitné vody, nejen jako řešení občasných havarijních situací, ale především jako náhrada za pitnou vodu distribuovanou veřejnými vodovody. Což znamená, že se vedle vybraných druhů minerálních vod začaly stáčet i vody z kvalitních podzemních zdrojů pitné vody, které nevykazovaly ani zvláštní chuť, ani zvláštní farmakologický účinek[2].
Znečištění vody
Hlavní článek: Znečištění vody
Voda má hodnotu nejen ekonomickou, ale i ekologickou. Pětina lidstva nemá přístup k nezávadné vodě. 2,6 miliardy lidí postrádá hygienické zázemí. Ve 20. století zmizelo 50% světových mokřadů. 3 miliony lidí ročně umírají na choroby způsobené kontaminovanou vodou a špatnou hygienou (např. průjmová onemocnění a malárie), 90% z nich jsou děti do pěti let. O to nepříjemnější je skutečnost, že se zásoby sladké vody na Zemi snižují. Podle odhadu Organizace pro výživu a zemědělství (FAO) klesly zásoby vody v Evropě o třetinu, v Asii o tři čtvrtiny a v Africe o dvě třetiny. Rozdíly mezi zásobami vody a její spotřebou se neustále prohlubují a lze přitom předpokládat, že spotřeba vody bude v následujících letech stále stoupat. Značná část znečištění životního prostředí pochází ze zemědělství (pesticidy, hnojiva i zvířecí exkrementy) a zasahuje i vodní zdroje. Pitná voda se stává strategickou surovinou a do intenzivně využívaných zemědělských oblastí se musí přivádět z velkých vzdáleností.
Bezpečnost
Chemické znečištění vody nelze převařením odstranit. Bakteriologické znečištění odstraníme povařením aspoň 5 minut. (Viry se usmrtí až po 30 minutách.)
Požadavky na jakost vody pro koupání ve volné přírodě upravuje vyhláška Ministerstva zdravotnictví č. 464/2000 Sb.
Voda v politice
Význam vody pro lidstvo podtrhlo vyhlášení „Evropské vodní charty“ dne 6. května 1968 ve Strasbourgu:
Evropská vodní charta
- Bez vody není života. Voda je drahocenná a pro člověka ničím nenahraditelná surovina.
- Zásoby sladké vody nejsou nevyčerpatelné. Je proto nezbytné tyto udržovat, chránit a podle možnosti rozhojňovat.
- Znečišťování vody způsobuje škody člověku i ostatním živým organismům, závislým na vodě.
- Jakost vody musí odpovídat požadavkům pro různé způsoby jejího využití, zejména musí odpovídat normám lidského zdraví.
- Po vrácení použité vody do zdroje nesmí tato zabránit dalšímu jeho použití pro veřejné i soukromé účely.
- Pro zachování vodních zdrojů má zásadní význam rostlinstvo, především les.
- Vodní zdroje musí být zachovány.
- Příslušné orgány musí plánovat účelné hospodaření s vodními zdroji.
- Ochrana vody vyžaduje zintenzivnění vědeckého výzkumu, výchovu odborníků a informování veřejnosti.
- Voda je společným majetkem, jehož hodnota musí být všemi uznávána. Povinností každého je užívat vodu účelně a ekonomicky.
- Hospodaření s vodními zdroji by se mělo provádět v rámci přirozených povodí a ne v rámci politických a správních hranic.
- Voda nezná hranic, jako společný zdroj vyžaduje mezinárodní spolupráci.
Historická poznámka
Iónský filosof Thalés z Milétu v 6. století př. n. l. pokládal vodu za základní element své kosmologie. Jeho následovníci až do Aristotela přidali další základní elementy, jako je oheň, země a vzduch, což potom dominovalo islámskému a křesťanskému myšlení. Čtyřprvkový princip přetrval až do Isaaca Newtona (De Natura Acidorum - myšlenka, že všechny látky lze převést na vodu). Až v 19. století přejal roli vody vodík. Přesné stechiometrické výpočty atomových hmotností jiných prvků však později ukázaly, že nemohou být jednoduchými násobky atomové hmotnosti vodíku.
Reference
- ↑ Novela názvosloví organické chemie – přehled změn – bod 3.2
- ↑ Stručné základy názvosloví organických sloučenin
- ↑ Chemické názvosloví a názvy lékových forem v ČL 2002
- ↑ Předmluva
- ↑ Názvosloví vycházející z jiných hydridů
- ↑ Stanovisko Komise pro životní prostředí Akademie věd ČR k diskusi o klimatických změnách - bod 7.4.
- ↑ M. Kravčík et al., Water for the recovery of the climate. Praha 2008, str. 17.
Související články
- led
- povodeň, tsunami, eroze
- sucho, zavlažování, hydroponie, akvakultura, akvárium
- oceán, Slapové jevy, moře, průliv
- řeka, potok, jezero, rybník, polder nebo poldr
- zavlažovací kanál, průplav, plavební komora
- evapotranspirace
- dehydratace
- Dezertifikace
- čištění vody, úpravna vod, odsolování, zásobování vodou
- vodní kolo, vodní turbína, vodní elektrárna, vodní energie, vodní trkač - čerpadlo
- vodní dílo
- parní turbína, parní stroj
- parní kotel (odlučovač vody), pračka, vodní kámen, kotelní kámen
Literatura
- M. Kravčík et al., Water for the recovery of the climate. Praha 2008. ISBN 978-80-89089-71-0
Externí odkazy
- Balená voda versus voda z vodovodu
- Water Structure and Behavior / M. Chaplin. - London South Bank University
- Water resources across Europe — confronting water scarcity and drought - EEA Report No 2/2009
- Josef Kučera:Voda má 66 anomálií. Vědci začali odhalovat jejich příčiny idnes.cz, 12. září 2009
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |