Multimediaexpo.cz je již 18 let na českém internetu !!
Atom
Z Multimediaexpo.cz
m (Nahrazení textu) |
m (1 revizi) |
Verze z 27. 12. 2013, 09:19
| Atom | ||||||
|---|---|---|---|---|---|---|
| ||||||
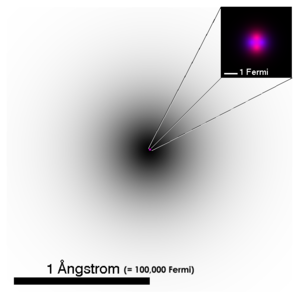
| Znázornění struktury atomu helia. Elektronový obal, sestávající z orbitalu 1s, je zobrazen černě, přičemž odstín vyjadřuje hustotu pravděpodobnosti (integrovanou podél přímky pohledu). Zvětšené atomové jádro je zobrazeno jen schematicky, růžově jsou zobrazeny protony a fialově neutrony. Ve skutečnosti je i jádro helia (a vlnové funkce jednotlivých nukleonů) kulově symetrické. | ||||||
| Zatřídění | ||||||
| ||||||
| Vlastnosti | ||||||
|
Atom (z řeckého ἄτομος, átomos – nedělitelný) je základní částice běžné hmoty, částice, kterou už chemickými prostředky dále nelze dělit a která definuje vlastnosti daného chemického prvku. Atom se skládá z atomového jádra obsahujícího protony a neutrony a obalu obsahujícího elektrony.
Obsah |
Historický vývoj atomové teorie
První představy o atomu pochází z antického Řecka, ve kterém v 5. století př. n. l. Démokritos představil filosofickou teorii, podle které nelze hmotu dělit donekonečna, neboť na nejnižší úrovni existují dále nedělitelné částice, které označil slovem atomos (ἄτομος). Podle této teorie je veškerá hmota složena z různě uspořádaných atomů různého druhu, které jsou nedělitelné, přičemž je nelze vytvářet ani ničit.
Vědeckou formu atomové teorii poskytl na začátku 19. století John Dalton, podle kterého se každý chemický prvek skládá ze stejných atomů zvláštního typu, které nelze měnit ani ničit, ale lze je skládat do složitějších struktur (sloučenin). Na základě této teorie byl schopen vysvětlit některé otevřené otázky tehdejší chemie, např. proč při chemických reakcích reagují vždy jednoduché poměry množství příslušných látek (viz zákon násobných poměrů slučovacích).
Teorii o nedělitelných atomech (přesněji částic, které atomy nazval Dalton) však v roce 1897 vyvrátil J. J. Thomson, který při studiu katodového záření objevil elektron - tedy první subatomární částici. Na základě tohoto objevu vytvořil tzv. Thomsonův model atomu (též pudinkový model), který předpokládal, že atom je tvořen rovnoměrně rozloženou kladně nabitou hmotou, ve které jsou (jako rozinky v pudinku) rozptýleny záporně nabité elektrony.
Tento model překonal na začátku 20. století Ernest Rutherford, který při svých pokusech dokázal, že většina hmoty s kladným nábojem je umístěna ve velmi malém prostoru ve středu atomu. To ho vedlo k Rutherfordově modelu, podle kterého se atom skládá z kladně nabitého hutného jádra, kolem kterého obíhají záporně nabité elektrony obdobně jako planety obíhají Slunce (proto se tento model nazývá též planetární model atomu). Později také zjistil, že jádro atomu vodíku je nejjednodušším jádrem, které je tvořeno jedinou částicí, přičemž tato částice je obsažena také v jádrech ostatních atomů. Tato částice se nazývá proton. V roce 1932 pak James Chadwick objevil neutron, který se v jádře nachází spolu s protony.
Planetární model však trpěl mnoha zásadními nedostatky: například podle všech známých zákonů by elektricky nabité těleso (elektron) obíhající po kruhové či eliptické dráze muselo vysílat elektromagnetické záření, čímž by ztrácelo energii a ve velmi krátkém čase by se všechny elektrony spirálovitě zřítily do atomových jader.
Tyto zásadní problémy překonala až nová kvantová teorie, podle které je elektromagnetické záření vysíláno i pohlcováno po nedělitelných množstvích, kvantech. V roce 1913 vytvořil Niels Bohr podle této teorie Bohrův model atomu. Podle tohoto modelu obíhají elektrony atomové jádro jen na některých dovolených drahách, přičemž nemohou vyzařovat a spirálovitě padat do jádra, protože mezilehlé dráhy nejsou možné a vyzařování energie není spojité, mohou pouze za určitých podmínek jednorázovými změnami „přeskočit“ z jedné energetické hladiny do jiné.
Bohrův model byl navržen ad hoc, byl poměrně komplikovaný, ale dokázal předpovědět několik důležitých faktů o atomových spektrech. V některých ohledech však stále selhával (např. vysvětlení štěpení spektrálních čar). Bohrův model je stále založen na klasické fyzice, na rozdíl od planetárního modelu však využil některých závěrů kvantové fyziky, kterými se pokusil odstranit nedostatky planetárního modelu. Je to tedy jakási směsice, o které byl samotný Bohr přesvědčen, že nemůže být konečným vysvětlením. Jeho model však nabízel zajímavé myšlenky (ač nebylo zřejmé, odkud se vzaly), které pomohly k hlubšímu poznání stavby atomu.
Moderní kvantově mechanický model atomu vznikl na základě de Broglieho teorie částicových vln a následné Schrödingerovy práce, v níž představil tzv. Schrödingerovu rovnici, podle které elektron (stejně jako všechny ostatní částice) není popisován jako hmotný bod, ale jako vlnová funkce definující pravděpodobnosti výskytu elektronu v různých místech prostoru. Spolu s Heisenbergovými relacemi neurčitosti to znamená, že elegantní pravidelné eliptické dráhy Bohrova modelu byly opuštěny a nahrazeny neostře definovanými oblastmi, ve kterých se elektron s určitou pravděpodobností nalézá, tzv. orbitaly. Tento model je sice hůře pochopitelný a jeho pravděpodobnostní povaha zejména zpočátku přitahovala značnou kritiku, dokáže však vysvětlit mnoho atomových vlastností, které byly dřívějšími teoriemi nepředpověditelné.
Kvantově mechanický model je již zcela založen na principech kvantové fyziky.
Složení atomu
Přestože podle jména je atom „nedělitelný“, ve skutečnosti jej lze rozložit na menší složky, někdy označované jako subatomární částice:
- elektrony jsou záporně nabité částice, které se nacházejí v atomovém obalu, ze kterého je lze relativně snadno vyjmout a vytvořit tím nabitý iont (viz ionizace)
- ve středu atomu je atomové jádro obsahující tzv. nukleony (jejich velikost je ve srovnání s elektronem nepatrná, ale tvoří naprostou většinu hmotnosti atomu):
Elektrony jsou k atomovému jádru vázány elektromagnetickou silou zprostředkovávanou fotony. Protony a neutrony v jádře jsou navzájem vázány silnou jadernou silou zprostředkovanou gluony.
Samotné protony a neutrony se ještě skládají z kvarků.
Druhy atomů
Různé atomy se liší svým složením: počtem jednotlivých částic. Atomy různých prvků se liší svým atomovým číslem, které vyjadřuje počet protonů v jádře (např. atom se šesti protony je atomem uhlíku; počet elektronů v obalu je u běžného elektricky neutrálního atomu shodný s počtem protonů v jádře). Atomy jednoho prvku se mohou lišit počtem neutronů v jádře (tzv. nukleonovým číslem), čímž tvoří různé izotopy (např. atom s šesti protony a osmi neutrony je izotop uhlík 14, 14C). Pokud se z elektricky neutrálního atomu vyjme elektron (nebo se naopak do něj vloží), vznikne nabitý iont.
Je známo asi 256 druhů atomů (izotopů), které jsou stabilní, a mnoho dalších, jejichž jádra jsou nestabilní a samovolně se radioaktivně rozpadají.
Exotické druhy
V atomovém jádře může být nukleon nahrazen hyperonem, zpravidla hyperonem Λ. Jedná se pak o atom s hyperjádrem.
Elektron v atomovém obalu může být nahrazen mionem (nebo lehčím záporně nabitým mezonem, např. pionem). Takový atom se pak nazývá mioatomem (resp. mezoatomem). Vyhledem k větší hmotnosti je klasický Bohrův poloměr mioatomu mnohem menší, mion je vázán těsněji a je vysoká pravděpodobnost záchytu mionu jádrem (obdoba záchytu elektronu u radioaktivní přeměny beta). Atomové orbitaly mezoatomů se liší nejen kvůli odlišné hmotnosti, ale také tím, že k popisu kvantověmechanického chování mezonu v obalu je nutno použít Kleinovu-Gordonovu rovnici (na rozdíl od Diracovy rovnice pro elektron). Také jádro (u atomu vodílu) může být také nahrazeno antimionem (nebo kladně nabitým mezonem).
Někdy bývá za exotický atom považováno i tzv. pozitronium a mionium, vázané soustavy pozitronu a elektronu, resp. mionu a antimionu (kladně nabitý lepton nahrazuje klasické atomové jádro).
Všechny exotické atomy jsou nestabilní.
Atomy a molekuly
V plynech, kapalinách a některých pevných látkách jsou atomy chemickými vazbami vázány do molekul. V jiných pevných látkách jsou atomy vázány přímo bez tvorby molekul. Tak vznikají krystalické látky; zvláštním případem jsou molekulární krystaly.
Související články
Literatura
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood - A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
Externí odkazy
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |
