The final launch of the Allmultimedia.org will take place on February 24, 2026
(shortly after the 2026 Winter Olympics).
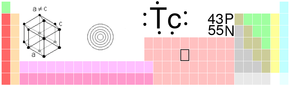
Technecium
Z Multimediaexpo.cz
m (1 revizi) |
(+ Výrazné vylepšení) |
||
| Řádka 19: | Řádka 19: | ||
|- | |- | ||
|[[Registrační číslo CAS]]||7440-26-8 | |[[Registrační číslo CAS]]||7440-26-8 | ||
| - | |||
| - | |||
|} | |} | ||
'''Technecium''', chemická značka '''Tc''', lat. ''Technetium'' je nejlehčím prvkem periodické soustavy, který nemá žádný stabilní [[izotop]]. | '''Technecium''', chemická značka '''Tc''', lat. ''Technetium'' je nejlehčím prvkem periodické soustavy, který nemá žádný stabilní [[izotop]]. | ||
== Základní fyzikálně-chemické vlastnosti == | == Základní fyzikálně-chemické vlastnosti == | ||
| - | Existence technecia byla předpovězena již roku 1871 | + | Existence technecia byla předpovězena již roku 1871 Dmitrijem Ivanovičem Mendělejevem, který jej nazval eka-mangan. Skutečný důkaz existence tohoto prvku však podali teprve roku [[1937]] Italové [[Carlo Perrier]] a [[Emilio G. Segré]] ve vzorku kovového [[molybden]]u, který byl v [[cyklotron]]u vystaven bombardování jádry [[deuterium|deuteria]]. |
Údaje o chemickém chováni a vlastnostech technecia vycházejí většinou spíše z analogií a teoretických výpočtů, protože pro praktické experimenty není k dispozici dostatečné množství materiálu. | Údaje o chemickém chováni a vlastnostech technecia vycházejí většinou spíše z analogií a teoretických výpočtů, protože pro praktické experimenty není k dispozici dostatečné množství materiálu. | ||
Ve sloučeninách se vyskytuje především v řadě mocenství od Tc<sup>+1</sup> po Tc<sup>+7</sup>, z nichž nejstálejší jsou sloučeniny Tc<sup>+7</sup>. | Ve sloučeninách se vyskytuje především v řadě mocenství od Tc<sup>+1</sup> po Tc<sup>+7</sup>, z nichž nejstálejší jsou sloučeniny Tc<sup>+7</sup>. | ||
== Výskyt a využití == | == Výskyt a využití == | ||
| - | V přírodě se technecium vyskytuje jen v mimořádně stopových množstvích jako produkt radioaktivního rozpadu [[uran (prvek)|uranu]] <sup>235</sup>U. Přitom z 1 g uranu vznikne pouze asi 27 mg Tc. Ve vesmíru bylo prokázáno stopové množství technecia v emisním [[spektrum|spektru]] hvězd typu [[ | + | [[Soubor:Technetium-99m Generator-Flickr.jpg|thumb|240px|Technetium-99m Generator]] |
| - | V současné době je známo celkem 35 [[radioizotop]]ů technecia, z nichž nejvýznamnější jsou <sup>97</sup>Tc, <sup>98</sup>Tc a <sup>99</sup>Tc. Poslední dva jsou beta-zářiče s [[ | + | V přírodě se technecium vyskytuje jen v mimořádně stopových množstvích jako produkt radioaktivního rozpadu [[uran (prvek)|uranu]] <sup>235</sup>U. Přitom z 1 g uranu vznikne pouze asi 27 mg Tc. Ve vesmíru bylo prokázáno stopové množství technecia v emisním [[spektrum|spektru]] hvězd typu [[Červený obr|rudých obrů]] a tento důkaz slouží jako jeden ze zdrojů teorie o přeměně prvků uvnitř hvězdných jader. |
| + | V současné době je známo celkem 35 [[radioizotop]]ů technecia, z nichž nejvýznamnější jsou <sup>97</sup>Tc, <sup>98</sup>Tc a <sup>99</sup>Tc. Poslední dva jsou beta-zářiče s [[Poločas přeměny|poločasem rozpadu]] 4,2×10<sup>6</sup> a 2,1×10<sup>5</sup> roku, využívané v [[biologie|biologii]] a medicíně pro sledování [[Metabolismus|metabolizmu]] vybraných sloučenin a sledování [[kost]]ní tkáně. Uměle lze tyto [[izotop]]y poměrně jednoduše připravit z izotopů [[molybden]]u <sup>97</sup>Mo a <sup>98</sup>Mo jejich bombardováním [[neutron]]y v jaderném reaktoru. | ||
== Literatura == | == Literatura == | ||
* Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973 | * Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973 | ||
| Řádka 41: | Řádka 40: | ||
* Periodická tabulka prvků [http://www.tabulka.cz/] | * Periodická tabulka prvků [http://www.tabulka.cz/] | ||
| - | {{Tabulka prvků}} | + | {{Tabulka prvků}}{{Flickr|Technetium}}{{commonscat|Technetium}}{{Článek z Wikipedie}} |
| - | {{commonscat|Technetium}} | + | |
| - | {{Článek z Wikipedie}} | + | |
[[Kategorie:Chemické prvky]] | [[Kategorie:Chemické prvky]] | ||
[[Kategorie:Kovy]] | [[Kategorie:Kovy]] | ||
Aktuální verze z 7. 11. 2017, 15:29
| Technecium | |
| |
| Atomové číslo | 43 |
| Relativní atomová hmotnost | 98(0) amu |
| Elektronová konfigurace | [Kr] 4d5 5s2 |
| Elektronegativita (Pauling) | 1,9 |
| Teplota tání | 2157 °C (2430 K) |
| Teplota varu | 4265 °C (4538 K) |
| Hustota | 11 g.cm-3 |
| Registrační číslo CAS | 7440-26-8 |
Technecium, chemická značka Tc, lat. Technetium je nejlehčím prvkem periodické soustavy, který nemá žádný stabilní izotop.
Obsah |
Základní fyzikálně-chemické vlastnosti
Existence technecia byla předpovězena již roku 1871 Dmitrijem Ivanovičem Mendělejevem, který jej nazval eka-mangan. Skutečný důkaz existence tohoto prvku však podali teprve roku 1937 Italové Carlo Perrier a Emilio G. Segré ve vzorku kovového molybdenu, který byl v cyklotronu vystaven bombardování jádry deuteria. Údaje o chemickém chováni a vlastnostech technecia vycházejí většinou spíše z analogií a teoretických výpočtů, protože pro praktické experimenty není k dispozici dostatečné množství materiálu. Ve sloučeninách se vyskytuje především v řadě mocenství od Tc+1 po Tc+7, z nichž nejstálejší jsou sloučeniny Tc+7.
Výskyt a využití
V přírodě se technecium vyskytuje jen v mimořádně stopových množstvích jako produkt radioaktivního rozpadu uranu 235U. Přitom z 1 g uranu vznikne pouze asi 27 mg Tc. Ve vesmíru bylo prokázáno stopové množství technecia v emisním spektru hvězd typu rudých obrů a tento důkaz slouží jako jeden ze zdrojů teorie o přeměně prvků uvnitř hvězdných jader. V současné době je známo celkem 35 radioizotopů technecia, z nichž nejvýznamnější jsou 97Tc, 98Tc a 99Tc. Poslední dva jsou beta-zářiče s poločasem rozpadu 4,2×106 a 2,1×105 roku, využívané v biologii a medicíně pro sledování metabolizmu vybraných sloučenin a sledování kostní tkáně. Uměle lze tyto izotopy poměrně jednoduše připravit z izotopů molybdenu 97Mo a 98Mo jejich bombardováním neutrony v jaderném reaktoru.
Literatura
- Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.:Analytická chemie, SNTL, Praha 1974
- N. N. Greenwood - A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
Externí odkazy
- Periodická soustava a tabulka vlastností prvků [1]
- Chemický vzdělávací portál [2]
- WebElements (anglicky) [3]
- Periodická tabulka prvků [4]
|
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |

