Návštěvnost dne 25. února 2026 byla — 484 927 unikátních návštěvníků !
Návštěvnost dne 26. února 2026 byla — 479 665 unikátních návštěvníků !
Návštěvnost dne 5. března 2026 byla — 475 445 unikátních návštěvníků !
Neon
Z Multimediaexpo.cz
| Neon | |
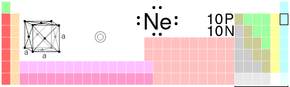
| |
| Chemická značka | Ne (lat. Neonum) |
| Atomové číslo | 10 |
| Izotopy | 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 |
| Relativní atomová hmotnost | 20,183 amu |
| Elektronová konfigurace | [He] 2s2 2p6 |
| Skupenství | Plynné |
| Teplota tání | -248,4 °C (24,7 K) |
| Teplota varu | -245,9 °C (27,2 K) |
| Ve vzduchu | 0,0018% |
| Skupenské teplo varu při -246 °C | 1,84 kJ/mol |
| Skupenské teplo tání při -249 °C | 0,326 kJ/mol |
| Kritická teplota | -228,7 °C |
| Kritický tlak | 2,26 atm |
| Kritická hustota | 0,4 |
Neon (latinsky Neonum) chemická značka Ne je plynný chemický prvek, patřící mezi vzácné plyny
Obsah |
Základní fyzikálně - chemické vlastnosti
Bezbarvý plyn, bez chuti a zápachu, nereaktivní, naprosto inertní. Chemické sloučeniny neonu nejsou známy. V 1 litru vody se při 20 °C rozpustí 10,4 ml neonu. Při velmi nízkých teplotách je možno neon zachytit na aktivním uhlí. Neon má velmi dobrou elektrickou vodivost, stejně jako i ostatní vzácné plyny. Má totiž velmi malý elektrický odpor. Toho se využívá v osvětlovací technice. Neon má ve výbojkách šarlatovou barvu.
Historický vývoj
Po té co William Ramsay objevil helium a spolu s lordem Rayleightem argon a správně oba plyny zařadil do periodické tabulky prvků, zůstalo mu volné místo před a za argonem. Podle těchto volných míst předpověděl William Ramsay v roce 1897 neon a krypton. Neon byl objeven o rok později (tedy roku 1898) Williamem Ramsayem a Morrisem Traversem, kdy William Ramsay využil nové metody frakčního destilace zkapalněného vzduchu a zároveň s neonem objevil i krypton a xenon. Neon byl pojmenován dvanáctiletým Ramseyovým synem, který se se zájmem díval na nové, šarlatově červené světlo, které vycházelo ze spektrální trubice. Syn navrhl tento prvek pojmenovat jako nový - neon.
Výskyt a získávání
Je přítomen v zemské atmosféře v koncentraci přibližně 0,0018% (Ve 100 litrech vzduchu je přibližně 1,82 ml neonu). Je proto získáván frakční destilací zkapalněného vzduchu. Další možností získávání neonu je frakční adsorpce na aktivní uhlí, při teplotách kapalného vzduchu.
Využití
Elektrickým výbojem v prostředí neonu o tlaku několik torrů vzniká intenzivní světelné záření oranžově-červené (šarlatové) barvy. Tohoto jevu se využívá pří výrobě výbojek tzv. neonek, která slouží jako osvětlovací tělesa nebo různé světelné indikátory. Spolu s heliem lze neon využít i v obloukových lampách a doutnavkách. Neonové trubice se používají v různých oblastech elektrotechniky (usměrňovače, pojistky, reduktory napětí…). Kapalný neon se využívá v kryogenní technice jako náhrada dražšího a obtížněji připravitelného kapalného helia. Neon slouží i jako náplň do některých typů laserů.
Literatura
- Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.:Analytická chemie, SNTL, Praha 1974
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood - A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
Externí odkazy
- Periodická soustava a tabulka vlastností prvků [1]
- Chemický vzdělávací portál [2]
- WebElements (anglicky) [3]
- Periodická tabulka prvků [4]
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |

