The final launch of the Allmultimedia.org will take place on February 24, 2026
(shortly after the 2026 Winter Olympics).
Dovolená : 23. prosinec 2025 — 29. prosinec 2025
Holidays : December 23, 2025 — December 29, 2025
Ethan
Z Multimediaexpo.cz
Ethan (mimo chemii dle PČP etan) je druhý nejjednodušší nasycený uhlovodík, patřící mezi alkany. Za normálních podmínek je to bezbarvý hořlavý plyn bez zápachu jen nepatrně těžší než vzduch. Ve směsi se vzduchem, obsahující 3 až 12,5 % ethanu, snadno exploduje.
Obsah |
Příprava
Průmyslově se připravuje frakčním zkapalňováním zemního plynu nebo ropných plynů.
V laboratoři jej lze připravit řadou způsobů, např. působením jodovodíku na ethanol
- CH3CH2OH + 2 HI → CH3CH3 + I2 + H2O,
případně redukcí jodethanu (ethyljodidu) zinkem ve vodném prostředí
- CH3CH2I + Zn + H2O → CH3CH3 + Zn++ + I− + OH−.
Jinou možností je syntéza Wurtzovou reakcí z jodmethanu (methyljodidu) působením zinku v bezvodém prostředí
- 2 CH3I + Zn → CH3CH3 + ZnI2.
Běžně používaným laboratorním způsobem přípravy je Kolbeho syntéza, spočívající v elektrochemické oxidaci roztoku octanu sodného nebo draselného na anodě, přičemž v první stupni vzniká vysoce reaktivní radikál methyl
- CH3COO− → CH3· + CO2 + e−;
následně se pak dva tyto radikály spojí na ethan
- 2 CH3· → CH3CH3.
Vlastnosti
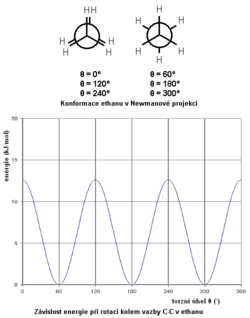
Geometrie molekul ethanu
Ethan je nejjednodušším alkanem, u kterého lze pozorovat různá prostorová uspořádání, související s téměř volnou otáčivostí dvou methylových skupin CH3 kolem vazby C—C mezi oběma uhlíky v molekule. Tyto různé prostorové konfigurace molekul obecně nazýváme konformace a molekulu, zaujímající určitou konformaci, nazýváme konformer. V závislosti na úhlu θ, zvaném torzní úhel, který svírají roviny C—C—H a H—C—C definované vodíky na sousedních uhlících, se však mění potenciální energie molekuly. Protože se vodíkové atomy vzájemně odpuzují, je potenciální energie konforméru s θ = 0º (tzv. „zákrytová“ konformace) vyšší, než v případě hodnoty úhlu θ = 60º (tzv. nezákrytová konformace) a to o 12,6 kJ/mol. Proto za normální teploty většina molekul ethanu (až 99 %) bude mít konformaci blízkou hodnotám úhlu θ = 60º, 180º nebo 300º (v rozmezí ±30º), přičemž všechny tyto tři konformace budou energeticky rovnocenné. Nejstabilnější konformace má symetrii odpovídající bodové grupě D3d,
Tepelná kinetická energie molekul za normální teploty (20 °C) je 3,7 kJ/mol, tedy srovnatelně velká s energetickou bariérou, bránící volné rotaci kolem vazby C—C. Proto za těchto podmínek jeden konformer spontánně přechází v jiný, přičemž doba, potřebná pro přechod (přetočení) z jedné konformace do druhé, je řádově 10−11 s.
Chemické reakce ethanu
S nadbytkem vzduchu (kyslíku) se ethan spaluje na vodu a oxid uhličitý
- 2 C2H6 + 7 O2 → 4 CO2 + 6 H2O.
Při menším množství kyslíku vzniká místo oxidu uhličitého oxid uhelnatý
- 2 C2H6 + 5 O2 → 4 CO + 6 H2O,
při jeho nedostatku se ethan spaluje pouze na vodu a uhlík (saze)
- 2 C2H6 + 3 O2 → 4 C + 6 H2O.
Citlivou oxidací může být přeměněn na kyselinu octovou
- C2H6 + 3 O2 → CH3COOH + H2O.
nebo na ethanol
- 2 C2H6 + O2 → 2 C2H5OH
Zahříváním na vysokou teplotu kolem 900 °C ve směsi s vodní parou (proces zvaný hydrokrakování) se z molekuly ethanu odštěpuje vodík a vzniká nejjednodušší nenasycený uhlovodík (alken neboli olefin) ethen (ethylen)
- CH3CH3 → CH2═CH2 + H2,
který je významnou chemickou surovinou. Probíhá-li obdobná reakce za přítomnosti chloru při teplotách kolem 500 °C, vzniká jiná významná surovina, chlorethen (vinylchlorid)
- CH3CH3 + 2 Cl2 → CH2═CHCl + 3 HCl.
Přes nevýhody této metody (silně korozivní prostředí chlorovodíku za značně vysokých teplot), je přesto průmyslově využívána.
Reakcí s chlorem vzniká směs chlorovaných derivátů, v prvním stupni pak chlorethan (ethylchlorid)
- C2H6 + Cl2 → C2H5Cl + HCl.
Reakce má radikálový řetězový charakter. Je inciována zahřátím nebo světlem (zejména ultrafialovým) a může probíhat bouřlivě, až explozivně.
Reakcí s anilinem lze z ethanu připravit fenylethylamin:
C6H5NH2 + C2H6 → C6H5C2H4NH2 + H2.
Fyziologické vlastnosti
Při vdechnutí má slabě narkotické účinky.
Výskyt v přírodě
Tvoří 1–6% zemního plynu, lze ho nalézt rozpuštěný i v ropě.
Spektroskopicky byl prokázán v atmosférách velkých planet Sluneční soustavy (Jupiter, Saturn, Uran a Neptun) a v atmosféře Saturnova měsíce Titanu. Byl také objeven v komách komet.
Je též jednou z molekul nacházejících se v mezihvězdných plynových oblacích.
Použití
Ethan je významnou chemickou surovinou, která je zpracovávána především v nalezištích zemního plynu a v petrochemických závodech, kde odpadá při zpracování ropy. Nejdůležitějšími výrobky z ethanu jsou ethen (ethylen) a chlorethen (vinylchlorid) pro výrobu plastů a kyselina octová.
Používá se také v chladírenství jako teplonosné médium.
V mikrobiologii, fyziologii a lékařství se kapalný ethan používá ke zmrazování mikroskopických vzorků, neboť jejich prudkým ochlazením se zabrání krystalizaci vody, jejíž krystalky by jinak poškodily jemnou strukturu zkoumaného materiálu.
Historie
Ethan byl poprvé syntetizován v roce 1834 Michaelem Faradayem zmíněnou elektrolytickou oxidací octanu draselného v roztoku, který však vzniklý plynný produkt omylem považoval za methan, ale dále jej již nezkoumal. V létech 1847–1849. během pokusů, které měly potvrdit radikálovou teorii organické chemie, chemici Herman Kolbe a Edward Frankland připravili ethan redukcí propionitrilu (ethylkyanidu) respektive ethyljodidu kovovým draslíkem. Kolbe kromě toho jej připravil elektrolytickou metodou stejně jako Franklin (tato metoda byla později nazvána Kolbeho jménem). Oba dva chemici považovali ethan za radikál methyl. Teprve Carl Schorlemmer v roce 1864 správně popsal chemickou povahu této látky.
Původ jména
Jméno ethan bylo odvozeno od názvu ether, původně označujícího diethylether.
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |