Multimediaexpo.cz je již 18 let na českém internetu !!
Železo
Z Multimediaexpo.cz
m (Nahrazení textu „halštatské“ textem „halštatské“) |
m (Nahrazení textu „laténské“ textem „laténské“) |
||
| Řádka 2: | Řádka 2: | ||
== Základní fyzikálně - chemické vlastnosti == | == Základní fyzikálně - chemické vlastnosti == | ||
[[Soubor:Eisen 1.jpg|left|thumb|100px|Čisté železo]] | [[Soubor:Eisen 1.jpg|left|thumb|100px|Čisté železo]] | ||
| - | Železo je poměrně měkký, světle šedý až bílý, '''[[ferromagnetismus|ferromagnetický]] kov''' s malou odolností proti [[koroze|korozi]]. Železo je ferromagnetické do teploty 768 °C - tzv. [[Curieův bod]] - kdy tuto vlastnost ztrácí. Lidstvu je známo již od pravěku (objeveno na konci pravěku - období halštatské a | + | Železo je poměrně měkký, světle šedý až bílý, '''[[ferromagnetismus|ferromagnetický]] kov''' s malou odolností proti [[koroze|korozi]]. Železo je ferromagnetické do teploty 768 °C - tzv. [[Curieův bod]] - kdy tuto vlastnost ztrácí. Lidstvu je známo již od pravěku (objeveno na konci pravěku - období halštatské a laténské), přesto však jeho průmyslová výroba v masovém měřítku začíná teprve v 18. století našeho letopočtu. Železo patří mezi přechodné prvky, které mají valenční [[elektron]]y v d-orbitalu. Ve sloučeninách se vyskytuje především v mocenství Fe<sup>+2</sup> a Fe<sup>+3</sup>, sloučeniny Fe<sup>+4</sup> jsou velmi nestálé a nemají praktický význam. Sloučeniny Fe<sup>6+</sup> jsou velmi silná [[oxidační činidlo|oxidační činidla]], ale nejsou stabilní, a proto se nevyužívají. |
Chemicky je elementární železo značně nestálé a reaktivní. Velmi snadno se rozpouští působením minerálních kyselin. V [[kyselina chlorovodíková|kyselině chlorovodíkové]] se rozpouští za vzniku [[chlorid železnatý|chloridu železnatého]], který se velmi rychle oxiduje rozpuštěným [[kyslík]]em ve vodě na [[chlorid železitý]]. Ve zředěné [[kyselina sírová|kyselině sírové]] se železo rozpouští za vzniku [[síran železnatý|síranu železnatého]], který se ovšem delším stáním na vzduchu oxiduje na [[síran železitý]], v koncentrované kyselině sírové se železo rozpouští rovnou za vzniku síranu železitého. Ve zředěné [[kyselina dusičná|kyselině dusičné]] se železo rozpouští za vzniku [[dusičnan železitý|dusičnanu železitého]] a v koncentrované se pouze na povrchu [[Pasivace|pasivuje]] a nerozpouští. | Chemicky je elementární železo značně nestálé a reaktivní. Velmi snadno se rozpouští působením minerálních kyselin. V [[kyselina chlorovodíková|kyselině chlorovodíkové]] se rozpouští za vzniku [[chlorid železnatý|chloridu železnatého]], který se velmi rychle oxiduje rozpuštěným [[kyslík]]em ve vodě na [[chlorid železitý]]. Ve zředěné [[kyselina sírová|kyselině sírové]] se železo rozpouští za vzniku [[síran železnatý|síranu železnatého]], který se ovšem delším stáním na vzduchu oxiduje na [[síran železitý]], v koncentrované kyselině sírové se železo rozpouští rovnou za vzniku síranu železitého. Ve zředěné [[kyselina dusičná|kyselině dusičné]] se železo rozpouští za vzniku [[dusičnan železitý|dusičnanu železitého]] a v koncentrované se pouze na povrchu [[Pasivace|pasivuje]] a nerozpouští. | ||
Hydroxidy na železo za normální teploty nepůsobí, avšak zahříváním železných pilin s hydroxidem alkalického kovu vznikají [[železany]]. Působením vzdušné vlhkosti se železo snadno [[oxidace|oxiduje]] za tvorby hydratovaných oxidů (rez). Tato reakce přitom nevede k ochraně materiálu povrchovou pasivací jako u mnoha jiných kovových prvků, protože vrstva rzi se snadno odlupuje a koroze pokračuje do hloubky materiálu. V suchém vzduchu (bez vlhkosti) reaguje železo s [[kyslík]]em až při teplotě 150 °C a se samotnou vodou železo bez přítomnosti kyslíku vůbec nereaguje. Při žíhání železa ve vzduchu nebo jeho reakcí s vodní párou vzniká [[oxid železnato-železitý]] Fe<sub>3</sub>O<sub>4</sub>. Železo se přímo za horka slučuje s [[chlór]]em, [[síra|sírou]] a [[fosfor]]em a má schopnost se slučovat („slévat“) s [[uhlík]]em a [[křemík]]em, naproti tomu se železo vůbec neslučuje s [[dusík]]em. | Hydroxidy na železo za normální teploty nepůsobí, avšak zahříváním železných pilin s hydroxidem alkalického kovu vznikají [[železany]]. Působením vzdušné vlhkosti se železo snadno [[oxidace|oxiduje]] za tvorby hydratovaných oxidů (rez). Tato reakce přitom nevede k ochraně materiálu povrchovou pasivací jako u mnoha jiných kovových prvků, protože vrstva rzi se snadno odlupuje a koroze pokračuje do hloubky materiálu. V suchém vzduchu (bez vlhkosti) reaguje železo s [[kyslík]]em až při teplotě 150 °C a se samotnou vodou železo bez přítomnosti kyslíku vůbec nereaguje. Při žíhání železa ve vzduchu nebo jeho reakcí s vodní párou vzniká [[oxid železnato-železitý]] Fe<sub>3</sub>O<sub>4</sub>. Železo se přímo za horka slučuje s [[chlór]]em, [[síra|sírou]] a [[fosfor]]em a má schopnost se slučovat („slévat“) s [[uhlík]]em a [[křemík]]em, naproti tomu se železo vůbec neslučuje s [[dusík]]em. | ||
Verze z 17. 4. 2018, 18:20
Železo, chemická značka Fe, (latinsky: Ferrum) je nejrozšířenější přechodný kovový prvek a druhý nejrozšířenější kov na Zemi, je také hojně zastoupen i ve vesmíru. Lidstvu je znám již od pravěku. V přírodě se minerály železa vyskytují velmi hojně a železo se z nich získává redukcí ve vysoké peci. Objev výroby a využití železa byl jedním ze základních momentů vzniku současné civilizace. Železo má všestranné využití při výrobě slitin a pro výrobu většiny základních technických prostředků používaných člověkem. Velmi významné jsou také sloučeniny železa, ať už jde o anorganické, organické nebo komplexní. Železo je také velmi významným biogenním prvkem, v organismu se podílí na přenášení kyslíku k buňkám a tím umožňuje život mnoha organismů na naší planetě.
Obsah |
Základní fyzikálně - chemické vlastnosti
Železo je poměrně měkký, světle šedý až bílý, ferromagnetický kov s malou odolností proti korozi. Železo je ferromagnetické do teploty 768 °C - tzv. Curieův bod - kdy tuto vlastnost ztrácí. Lidstvu je známo již od pravěku (objeveno na konci pravěku - období halštatské a laténské), přesto však jeho průmyslová výroba v masovém měřítku začíná teprve v 18. století našeho letopočtu. Železo patří mezi přechodné prvky, které mají valenční elektrony v d-orbitalu. Ve sloučeninách se vyskytuje především v mocenství Fe+2 a Fe+3, sloučeniny Fe+4 jsou velmi nestálé a nemají praktický význam. Sloučeniny Fe6+ jsou velmi silná oxidační činidla, ale nejsou stabilní, a proto se nevyužívají. Chemicky je elementární železo značně nestálé a reaktivní. Velmi snadno se rozpouští působením minerálních kyselin. V kyselině chlorovodíkové se rozpouští za vzniku chloridu železnatého, který se velmi rychle oxiduje rozpuštěným kyslíkem ve vodě na chlorid železitý. Ve zředěné kyselině sírové se železo rozpouští za vzniku síranu železnatého, který se ovšem delším stáním na vzduchu oxiduje na síran železitý, v koncentrované kyselině sírové se železo rozpouští rovnou za vzniku síranu železitého. Ve zředěné kyselině dusičné se železo rozpouští za vzniku dusičnanu železitého a v koncentrované se pouze na povrchu pasivuje a nerozpouští. Hydroxidy na železo za normální teploty nepůsobí, avšak zahříváním železných pilin s hydroxidem alkalického kovu vznikají železany. Působením vzdušné vlhkosti se železo snadno oxiduje za tvorby hydratovaných oxidů (rez). Tato reakce přitom nevede k ochraně materiálu povrchovou pasivací jako u mnoha jiných kovových prvků, protože vrstva rzi se snadno odlupuje a koroze pokračuje do hloubky materiálu. V suchém vzduchu (bez vlhkosti) reaguje železo s kyslíkem až při teplotě 150 °C a se samotnou vodou železo bez přítomnosti kyslíku vůbec nereaguje. Při žíhání železa ve vzduchu nebo jeho reakcí s vodní párou vzniká oxid železnato-železitý Fe3O4. Železo se přímo za horka slučuje s chlórem, sírou a fosforem a má schopnost se slučovat („slévat“) s uhlíkem a křemíkem, naproti tomu se železo vůbec neslučuje s dusíkem. Významnou vlastností atomového jádra železa je skutečnost, že se vyznačuje nejvyšší vazebnou energií ze všech známých prvků. Prakticky to znamená, že při termojaderné fúzi, probíhající v nitru hvězd je železo posledním prvkem, který lze tímto způsobem připravit za vzniku energetického zisku. Naopak při štěpení jader těžkých prvků je jádro atomu železa prvním, z něhož nelze štěpením získat energii.
Historický vývoj
Železo je lidstvu známo již od prehistorické doby, avšak ne všechny nálezy v přírodě lze pokládat za lidské výtvory. Železné kuličky staré 6000 let, které se nachází v přírodě, jsou meteorického původu.[1] Ani později nalezené vzorky, které vznikly redukcí rud obsahujících železo dřevěným uhlím, nelze považovat za odlité člověkem, protože bez použití měchů nelze dosáhnout patřičné teploty pro jeho redukci.[1] První železo vzniklé činností člověka, které bylo možno opracovávat kovářským způsobem, je tzv. houbovité železo, které vzniklo nízkoteplotní redukcí železné rudy v tzv. zkujňovacím ohništi. Železná ruda se zahřívala v mělkých jamách s velkým přebytkem dřevěného uhlí rozdmýchávaného měchem. Získaly se tak slinuté kusy kujného železa, které se stavovaly mocným kováním. S tímto způsobem výroby železa se setkáváme prvně u Chetitů ve třetím tisíciletí před naším letopočtem.[2] Chetité výrobu železa velmi dobře střežili a k jeho rozšíření tak došlo teprve po rozpadu Chetitské říše někdy okolo roku 1200 př. n. l., kdy začíná doba železná.[2] Ve středověku se při zpracovávání přešlo od jam či plochých krbů k malým šachtovým pecím, z nichž se postupem času vyvinuly dnešní vysoké pece. Ve 14. století byl zaveden pohon dmýchadel vodní silou, což vedlo ke zvýšení teploty v peci a získalo se tak železo s větším obsahem uhlíku - litina. Ta sice není kujná, ale lidé se ji velmi brzy naučili zpracovávat na kujné železo novým zahříváním za vydatného přívodu vzduchu - tzv. zkujňování železa. Významný krok ve zpracování železných rud bylo zavedení koksu jako redukčního činidla na konci 18. století[3]. Jeho použití lze považovat za jeden z hlavních faktorů průmyslové revoluce.[1] Zkujňování železa bylo ve druhé polovině 19. století výrazně zlepšeno pomocí zkujňování větrem (pochod Bessemerův - tzv. Bessemerace 1878) a topení s regenerací tepla (proces Siemensův-Martinův 1865). V poslední době bylo pro výrobu vysoce kvalitních ocelí zavedeno tavení v elektrické peci.[3] (Viz kapitola Zpracování železa na ocel.)
Výskyt
- Další minerály železa naleznete v kategorii Minerály železa.
Železo patří vzhledem ke stálosti svého jádra mezi prvky s velmi významným zastoupením na Zemi i ve vesmíru. Železo se vyskytuje také na Měsíci, kde se v jeho zemské kůře vyskytuje v zastoupení 9 %. V měsíčním prachu je obsažen v kovové formě v množství okolo 0,5%, v průměrně dvanáctimetrové povrchové vrstvě se nachází okolo 1012 tun železa.[4] V zemské kůře činí průměrný obsah železa 4,7 – 6,2 % (62 000 ppm), čímž se řadí na 4. místo podle výskytu prvků (před ním je jen kyslík, křemík a hliník).[4] Předpokládá se, že zemské jádro je složeno především ze železa, kobaltu a niklu a celkový podíl železa na složení naší planety je ještě podstatně vyšší (podle některých údajů až 35 %). V mořské vodě se jeho koncentrace pohybuje pouze na úrovni 0,01 miligramů v jednom litru. Předpokládá se, že ve vesmíru připadá na jeden atom železa přibližně 40 000 atomů vodíku. V přírodě se železo vyskytuje ve formě sloučenin v mnoha rudách, které mohou být průmyslově využity k jeho výrobě. Nejvíce se vyskytuje ve formě oxidů a uhličitanů.[4] Z nejznámějších lze jmenovat např. hematit (krevel) Fe2O3, magnetit (magnetovec) Fe3O4, limonit (hnědel) Fe2O3 · x H2O, ilmenit FeTiO3 nebo siderit (ocelek) FeCO3. Známý je i sulfidický pyrit FeS2, který se však kvůli obtížnému oddělení síry od železa průmyslově tolik nezpracovává.[4] Co do obsahu železa, je z těchto rud nejhodnotnější magnetit, který obsahuje téměř tři čtvrtiny hmotnosti železa, ale nejhojněji se vyskytující rudou je hematit. Vzhledem k vysoké dostupnosti železných rud se vybírají ty kvalitnější. K méně známým rudám železa, které nelze využívat k jeho výrobě, patří například augit (Ca,Mg,Fe)SiO3, chromit (Fe, Mg)Cr2O4, kobaltin (Co,Fe)AsS, jakobsit MnFe2O4, andradit Ca3Fe23+(SiO4)3, olivín (Mg, Fe)2SiO4, triplit (Mn,Fe,Mg,Ca)2(PO4)(F,OH), vivianit Fe3(PO4)2·8(H2O) a wolframit (Fe,Mn)WO4. Elementární kovové železo, které lze nalézt na zemském povrchu, je buď pozemské nebo meteoritické. Pozemské je vzniklé nejspíše „přirozeným zhutněním“ železa obsaženého v bazaltech, přičemž se poukazuje na přítomnost uhelných vrstev nebo jejich uzavřenin (výskyty na ostrově Disko u Grónska či v Bühlu u Kasselu (Hesensko, Německo), u nás vzácně ze Strak u Duchcova). Meteorický původ železa je praktickým důkazem významné přítomnosti železa v okolním vesmíru a současně v minulosti bylo jediným zdrojem pro výrobu železných nástrojů (nože, zbraně, …).
Průmyslová výroba
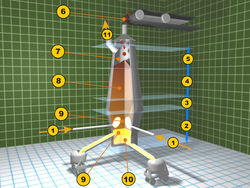
1. vhánění předehřátého vzduchu (~900 °C)
2. tavicí zóna (~2000 °C)
3. zóna redukce oxidu železnatého FeO (700-1200 °C)
4. zóna redukce oxidu železitého Fe2O3 (200-700 °C)
5. předehřívací zóna (~200 °C)
6. zavážka (ruda, vápenec, koks)
7. odpadní plyny
8. sloupec rudy, koksu a vápence
9. odvod strusky
10. odběr surového železa
11. odvod odpadních plynů
(citace [5][6])
Velmi čisté železo se v menším množství vyrábí redukcí čistého oxidu nebo hydroxidu vodíkem nebo tzv. karbonylovým způsobem zahříváním železa v atmosféře oxidu uhelnatého CO při zvýšeném tlaku a následným rozkladem vzniklého pentakarbonylu železa Fe(CO)5 při teplotě 250 °C na práškový kov.[4] Surové železo se vyrábí ve vysoké peci redukcí svých oxidů koksem nebo oxidem uhelnatým. Upravené rudy se střídavě naváží se struskotvornými látkami (vápenec, oxidy křemíku) a koksem do vysoké pece. Ve vysoké peci probíhá několik dějů. V dolní části pece se spaluje koks na oxid uhličitý CO2 díky vhánění předehřátého vzduchu (popř. vzduchu obsahujícího topný olej).
- C + O2 → CO2
Touto exotermickou reakcí se pec v tzv. tavicí zóně vyhřívá na teplotu okolo 2 000 °C[5], což způsobí roztavení surového železa a tvorbu tzv. strusky. Struska je vrstva lehkých oxidů a silikátů, která chrání taveninu před zpětnou oxidací vzdušným kyslíkem.
- SiO2 + CaO → CaSiO3
Na dně se hromadí roztavené železo, odkud se vypouští odděleně od strusky. Ve vyšších vrstvách pece probíhá tzv. nepřímá redukce oxidů železa oxidem uhelnatým, tak se získají asi dvě třetiny vyrobeného železa. Nejdříve dochází k redukci oxidu železitého (přechodně vzniká oxid železnato-železitý Fe3O4) a k rozkladu vápence na oxid vápenatý CaO a oxid uhličitý (reakce potřebující méně energie):
- 3 Fe2O3 + CO → 2 Fe3O4 + CO2
- Fe3O4 + CO → 3 FeO + CO2
- CaCO3 → CaO + CO2
Ve více horké časti se redukuje vzniklý oxid železnatý a dochází k nedokonalému spalování koksu za vzniku dalšího oxidu uhelnatého.
- FeO + CO → Fe (s) + CO2
- C + CO2 → 2 CO
Ve spodních částech probíhá tzv. přímá redukce oxidů železa uhlíkem.
- Fe2O3 + 3 C → 2 Fe (s) + 3 CO
Celý proces probíhá prakticky nepřetržitě - na horní část vysoké pece se stále zaváží železná ruda, železný šrot, koks a struskotvorné přísady a naspodu se v určitých intervalech odpouští roztavené kovové železo - tzv. odpich vysoké pece.[7][8] Surové železo, tzv. litina, obsahuje řadu nežádoucích příměsí jako je uhlík C (3-5%), křemík Si a fosfor P.[9] V menší míře přijímá i síru S, která je ale více zadržena v podobě sulfidu manganatého MnS ve strusce. Surové železo se dobře odlévá, nejčastěji do forem požadované velikosti nebo do tzv. ingotů (housek).[9] Výsledný produkt, tzv. litina, je poměrně pevný a tvrdý, ale velmi křehký, a možnost jeho dalšího mechanického opracování po odlití je minimální. Z litiny se vyrábějí předměty, u kterých není vyžadována přesná rozměrová tolerance nebo vysoká odolnost proti nárazu. Příkladem mohou být pláty kamen, radiátory ústředního topení, kanálové poklopy nebo podstavce těžkých strojů. Struska se využívá ve stavebnictví k výrobě tvárnic, izolací stěn a některých druhů cementu.[5]
Zpracování železa na ocel
- Související informace můžete najít také v článku: Ocel
Obsah uhlíku v surovém železe je příliš vysoký a proto je nutné jej oxidačním procesem v ocelářských zařízeních snížit. Toho se dociluje oxidací uhlíku buďto kyslíkem ze vzduchu (Thomasův konvertor), profoukáváním kyslíkem (LD konvertor) nebo přisazováním železné rudy a ocelového odpadu do taveniny v nístějových pecích (Siemens-Martinův proces, elektrická oblouková pec). Získaná tzv. nelegovaná neboli měkká ocel je poměrně měkká a snadno se mechanicky zpracovává (tažení, kování, ohýbání atd.). Mechanické vlastnosti se dají dále upravovat tepelným zpracováním, například kalením (zahřátím do červeného žáru a prudkým zchlazením vodou, minerálním olejem) nebo popouštěním (zahřátím na 200-300 °C a pomalým chlazením).[9] Slouží k výrobě drátů, plechů, hřebíků a podobných produktů. Další zkvalitnění vyrobené oceli se dosahuje legováním, tedy přídavky definovaných množství jiných kovů za vzniku slitiny. Hlavními prvky pro legování ocelí jsou nikl, chrom, vanad, mangan, wolfram, kobalt a ve speciálních aplikacích ještě mnoho dalších. Rozlišujeme tzv. uklidněné a neuklidněné oceli. U uklidněných ocelí je rozpuštěný kyslík vázán přísadou hliníku (Al) nebo křemíku (Si). Existuje více než 2 000 různých druhů ocelí s přesně definovaným složením a mechanickými vlastnostmi, jako je pevnost, tvrdost, chemická odolnost a řada dalších. Ocelové polotovary jsou dále zpracovány ve válcovnách na drát, plech, nosníky, kolejnice, profily,které jsou široce používány v průmyslu, stavebnictví atd. Část těchto polotovarů slouží jako výchozí materiál pro výrobu výkovků v kovárnách.
Izotopy železa
V přírodě se nacházejí 4 izotopy. Nejvíce rozšířeným přírodním izotopem je vzhledem ke ke stabilitě svého jádra 56Fe (91,75%).[10] Uvedený izotop má nejvyšší hmotnostní schodek a tedy i největší vazebnou energii jádra ze všech známých izotopů.[11] Proto je také konečným produktem nukleosyntézy ve hvězdách. Zbývající tři stabilní izotopy jsou: 54Fe (5,85%[10]),57Fe (2,12%[10]) a 58Fe (0,28%[10]). 60Fe je zaniklý radionuklid dlouhým poločasem rozpadu (1,5 mil. let). Většina prací v minulosti týkajících se měření izotopové složení Fe se soustřeďovala na určování změn 60Fe vzhledem k procesům doprovázející nukleosyntézu (vznik jádra atomu z nukleonu) a formaci rudy. V posledním desetiletí pokrok v hmotnostní spektrometrii umožnil detekci rozdílů v řádově v minutách, což jsou přirozeně se vyskytující rozdíly stabilních izotopů železa. Velká část této práce byla hnána komunitou vědců zabývajících se Zemí a planetárními vědami, ačkoliv se začíná objevovat využití i v biologických a průmyslových systémech.[12]
Sloučeniny
- Další sloučeniny železa naleznete v kategorii Sloučeniny železa.
Ve sloučeninách se železo vyskytuje především v mocenství Fe+2 a Fe+3. Redox potenciál vzájemného přechodu výše zmíněných iontů leží v oblasti, která umožňuje současnou existenci obou forem vedle sebe. Železo se dále vyskytuje v oxidačním stavu Fe+4 a Fe+6. Sloučeniny těchto oxidačních stupňů železa nejsou příliš stabilní.[13]
Anorganické sloučeniny
S běžnými minerálními kyselinami tvoří železo soli v obou mocenstvích. V bezvodém stavu je většina solí bezbarvých a v hydratované podobě mají téměř všechny barvu - Fe+2 soli jsou nejčastěji bezbarvé až světle zelené a Fe+3 soli jsou nejčastěji tmavě žluté až hnědé.
Sloučeniny železnaté Fe2+
Nejvýznamnější železnatou sloučeninou je síran železnatý, triviálně zelená skalice. Železnaté soli jsou dobře rozpustné ve vodě, většinou jsou bezbarvé až světle zelené a snadno se oxidují na železité sloučeniny. Zelená barva vznikající ve oblasti viditelného spektra železnatých sloučenin je dána díky komplexu [Fe(H2O)6]2+.
- Oxid železnatý FeO je černá práškovitá hmota. Nerozpouští se ve vodě, ale v pyroforickém stavu (jemně rozptýleném) dokáže vodu rozkládá a to zvláště za tepla. Připravuje se tepelným rozkladem šťavelanu železnatého. Při tomto rozkladu se vylučuje ve své pyroforické podobě. Je stálý jen nad teplotou 575 °C, pod touto teplotou se rozkládá na železo a oxid železnato-železitý.
- Hydroxid železnatý Fe(OH)2 je bílá vločkovitá sraženina, nerozpustná ve vodě. Velmi rychle pohlcuje kyslík a přechází přes zelenou barvu až do hněda. Tento barevný pochod je způsoben oxidací hydroxidu železnatého na hydrát oxidu železitého. Hydroxid železnatý se připravuje srážením železnatých iontů ionty hydroxidovými.
- Sulfid železnatý FeS je v čistém stavu červenavě hnědá práškovitá látka, pokud se připravuje zahříváním železa se sírou, nebo černá práškovitá látka, pokud se připravuje srážením roztoků železnatých solí roztokem alkalického sulfidu. Sulfid železnatý je nerozpustný ve vodě a v přírodě se vyskytuje jako nerost pyrhotin.
- Disulfid železnatý FeS2 je mosazně žlutá krystalická látka s kovovým leskem, která se nerozpouští ve vodě. V přírodě se vyskytuje jako nerost pyrit a markazit. Laboratorně jej lze připravit zahříváním práškového železa v nadbytku síry.
- Fluorid železnatý FeF2 je bílá, ve vodě dobře rozpustná krystalická látka. V roztoku je schopen tvořit komplexní sloučeniny (viz níže) fluoroželeznatany. Fluorid železnatý připravuje se rozpouštěním železa v kyselině fluorovodíkové.
- Chlorid železnatý FeCl2 je v bezvodém stavu světle žlutá krystalická látka, v hydratované formě má modrozelenou barvu. Je dobře rozpustný ve vodě, ale velmi lehce se oxiduje na chlorid železitý a to i vzdušným kyslíkem. V roztoku dokáže vytvářet komplexní sloučeniny (viz níže) chloroželeznatany. Chlorid železnatý se připravuje převáděním par chlorovodíku přes rozžhavené železné piliny.
- Bromid železnatý FeBr2 je v bezvodém stavu žlutozelená látka, v hydratované podobě to je zelená krystalická látka, dobře rozpustná ve vodě. Připravuje se převáděním par bromu přes rozžhavené železnaté piliny.
- Jodid železnatý FeI2 je v bezvodém stavu šedá krystalická látka, v čistém hydratovaném stavu zelená krystalická látka, dobře rozpustná ve vodě. Připravuje se syntézou z prvků, tedy jodu a železa.
- Rhodanid železnatý neboli thiokyanatan železnatý Fe(SCN)2 je zelená krystalické látka, dobře rozpustná ve vodě. V roztoku je schopen tvořit komplexní sloučeniny (viz níže) rhodanoželeznatany. Na vzduchu se snadno oxiduje na rhodanid železitý. Rhodanid železnatý se připravuje rozpouštěním železa v kyselině rhodanovodíkové.
- Dusičnan železnatý Fe(NO3)2 je v hydratované formě zelená krystalická látka, velmi dobře rozpustná ve vodě. Na vzduchu je stálý, ale za vyšší teploty se snadno oxiduje na dusičnan železitý. Dusičnan železnatý se připravuje rozpouštěním železa ve studené zředěné kyselině dusičné.
- Síran železnatý FeSO4 je v bezvodém stavu bezbarvá práškovitá látka, v hydratované podobě je nejznámější jako FeSO4· 7 H2O, což je triviálně zelená skalice - zelená krystalická látka. Ve vodě je dobře rozpustná, na vzduchu se pomalu oxiduje a za vyšší teploty probíhá oxidace na síran železitý rychleji. Síran železnatý se připravuje rozpouštěním železa ve zředěné kyselině sírové a používá se k výrobě inkoustu, berlínské modři, v barvířství (barvení vlny na černo), ke konzervování dřeva, k ničení plevele a jako součást některých léků k zajištění dostatečného příjmu železa do organismu.
- Mohrova sůl (NH4)2Fe(SO4)2·6H2O je triviální název pro hexahydrát síranu amonnoželeznatého. Je to podvojná sloučenina síranu železnatého a síranu amonného, která je velmi dobře rozpustná ve vodě a využívá se v analytické chemii. Připravuje se krystalizací směsného roztoku síranu železnatého a síranu amonného.
- Uhličitan železnatý FeCO3 je bílá práškovitá látka, nerozpustná ve vodě, která se velmi rychle oxiduje na uhličitan železitý a oxid železitý, což se projeví změnou barvy z bílé na hnědou. Uhličitan železnatý se připravuje srážením roztoků železnatých solí roztokem alkalického uhličitanu.
- Kyanid železnatý nebyl doposud připraven, ale existují jeho komplexní sloučeniny (viz níže) kyanoželeznatany.
Sloučeniny železité Fe3+
Železité lze získat oxidací železnatých solí. Ve vodě jsou rozpustné podobně jako soli železnaté. Pokud jejich roztoky neobsahují přebytečnou kyselinu, je roztok hnědožlutý až tmavohnědý. Toto zbarvení je příčinou hydrolýzy železitých solí na hydroxid železitý, popřípadě vznikem zásaditých solí. Pokud budeme chtít hydrolýze zabránit přidáním nadbytečné kyseliny, tak často získáme acidokomplexní sloučeniny. Takovéto roztoky mají potom narůžovělou nebo žlutou barvu, nejčastěji jsou však bezbarvé. Pro velmi čisté železité sloučeniny je nutno upravit pH roztoku téměř na 0, při vyšším pH (okolo 2 - 3) se v roztoku vytváří koloidní gely, což vede ke vzniku červenohnědé sraženiny. Působením redukčních činidel se velmi lehce ze solí železitých připraví soli železnaté.
- Oxid železitý Fe2O3 je červenohnědý prášek, nerozpustný ve vodě. V přírodě se vyskytuje jako nerost hematit a v hydratované podobě jako nerost limonit. V laboratoři se připravuje žíháním hydroxidu železitého.[14]
- Hydroxid železitý Fe(OH)3 je červenohnědý prášek, nerozpustný ve vodě. V přírodě se vyskytuje jako nerost goethit a lepidokrokit. Čerstvě sražený hydroxid železitý je amfoterní a rozpouští se v kyselinách na železité soli i hydroxidech na železitany. Hydroxid železitý se připravuje srážením roztoků železitých solí roztokem alkalického hydroxidu.
- Sulfid železitý Fe2S3 je černá práškovitá látka, nerozpustná ve vodě. V přírodě se vyskytuje jako součást nerostu bornitu. Sulfid železitý připravuje se srážením roztoků železitých solí roztokem alkalického sulfidu.
- Diželezitan železnatý neboli oxid železnato-železitý Fe3O4 je černý, ve vodě, hydroxidech a kyselinách nerozpustný, ferromagnatický prášek, který se v přírodě vyskytuje jako magnetit. Má z oxidů železa z praktického hlediska největší význam – je důležitou surovinou pro výrobu železa a slouží jako surovina pro výrobu pigmentů červené až hnědé barvy. V laboratoři jej lze připravit působením vodní páry na rozžhavený prášek železa.[15][16]
- Ferity jsou pevné, nerozpustné, práškovité látky, nereagující s kyselinami ani hydroxidy. Mají obecný vzorec M2IFe2O4 a z hlediska systematického názvosloví je lze považovat za diželezitany. Za písmeno M v obecném vzorci lze dosadtit libovolný kov, pokud by se dosadil trojmocný, tak vznikne látka s tzv. antiferromagnetismem, který se nazývá ferimagnetismus. Ferity se používají na výrobu magnetických jader pro vysokofrekvenční transformátory. Ferity, které se označují jako hexagonální např. BaFe12O19, jsou také ferimagnetické a vyrábí se z nich permanentní magnety. Třetí z ferimagnetických sloučenin jsou granáty s obecným vzorcem M3IIIFe3O12. Nejznámější z nich je granát yttrium-železo používaný jako mikrovlnný filtr a v radarech.
- Fluorid železitý FeF3 je v bezvodém stavu nazelenalá krystalická látka a v hydratované podobě je to bledě růžová až světle žlutá krystalická látka, špatně rozpustná ve vodě. V roztoku tvoří komplexní sloučeniny (viz níže) fluoroželezitany. Připravuje se rozpouštěním hydroxidu železitého v kyselině fluorovodíkové.
- Chlorid železitý FeCl3 v bezvodém stavu černohnědá krystalická látka, v hydratované podobě je to žlutohnědá hygroskopická látka, která se působením vzdušné vlhkosti samovolně roztéká. V plynné fázi vytváří dimer Fe2Cl6. V roztoku tvoří komplexní sloučeniny sloučeniny (viz níže) chloroželezitany. Připravuje se působením chloru na rozžhavené železné piliny. Chlorid železitý se používá v elektrotechnice při výrobě plošných spojů jako leptadlo, rozpouštějící nechráněnou vrstvu kovové mědi. Za jistých podmínek jsou kyselé roztoky chloridu železitého schopny rozpouštět i kovové zlato. Používá se také jako vločkovací přísada při čištění odpadních vod.
- Bromid železitý FeBr3 je v bezvodém stavu hnědočervená krystalická látka a v hydratované podobě je tmavě zelená krystalická látka, dobře rozpustná ve vodě a svými vlastnostmi velmi podobná chloridu železitému. Připravuje se reakcí bromu s rozžhavenými železnými pilinami.
- Jodid železitý FeI3 je látka, kterou nelze získat v čistém stavu, jelikož v roztoku dokáže existovat pouze v rovnováze s velkým množstvím jodidu železnatého. Při reakci železité soli s jodidovými aniony totiž dochází k oxidaci jodidu na jod a a redukci železitého kationu na železnatý.
- Chloristan železitý Fe(ClO4)3 je v hydratované podobě slabě narůžovělá, silně hygroskopická krystalická látka, velmi dobře rozpustná ve vodě. Chloristan železitý v roztoku hydrolyzuje přičemž často polymeruje. Chloristan železitý se připravuje odkouřením chloridu železitého s kyselinou chloristou.
- Dusičnan železitý Fe(NO3)3 je v hydratované podobě bezbarvá krystalická látka, velmi dobře rozpustná ve vodě. Ve vodě však hydrolyzuje za vzniku hnědého roztoku, čemuž lze zamezit přidáním nadbytečné kyseliny dusičné. Dusičnan železitý se připravuje rozpouštěním železa v 20 - 30 % kyselině dusičné.
- Síran železitý Fe2(SO4)3 je v bezvodém stav bílý prášek a v podobě hydratované soli je to bílá krystalická látka, dobře rozpustná ve vodě. V přírodě se vyskytuje jako nerost coquimbit a quenstedtit. V roztoku vytváří snadno podvojné soli kamence, které jsou v čistém stavu bezbarvé a používají se jako mořidlo a v barvířství. Nejvýznamnější jsou kamenec železito-amonný a kamenec železito-draselný. Síran železitý se připravuje oxidací síranu železnatého nebo rozpouštění oxidu železitého v koncentrované kyselině sírové.
- Fosforečnan železitý FePO4 je nažloutlá práškovitá látka, nerozpustná ve vodě. V roztocích snadno přechází v komlpexní sloučeniny (viz níže) fosfatoželezitany, které jsou rozpustné a mají bílou barvu. Fosforečnan železitý se připravuje srážením roztoků železité soli roztokem alkalického fosforečnanu.
- Rhodanid železitý Fe(SCN)3 je krvavě červená krystalická látka, dobře rozpustná ve vodě. Ve vodě snadno vytváří komplexní sloučeniny (viz níže) rhodanoželezitany. Rhodanid železitý se připravuje reakcí železité soli s rhodanidovými aniony a následným vytřepáním v etheru.
Sloučeniny železičité Fe4+
Sloučeniny železičité nejsou pro železo vůbec typické a běžný člověk se s nimi nesetká. Železičité sloučeniny zastupují železičitany M4IFeO4, které tvoří černý krystalický prášek. Získávají se redukcí železanů v prostředí koncentrovaného hydroxidu nebo například zahříváním směsi hydroxidu s hexahydroxoželezitanem v proudu kyslíku při teplotě 500 - 800 °C.
Sloučeniny železové Fe6+
Sloučeniny železové jsou zastoupeny železany FeO42-. Mají červenou barvu, na vzduchu jsou relativně stálé, ale ve vodném roztoku v neutrálním a zejména kyselém prostředí se snadno rozpadají. Připravují se zahříváním železných pilin s dusičnanem nebo oxidací čerstvě sraženého hydroxidu železitého chlorem nebo bromem v prostředí hydroxidu. Po vychladnutí se vzniklá hmota rozpouští na jasně červenofialový roztok a s chloridem barnatým dává sraženinu železanu barnatého. Železany jsou velmi silná oxidační činidla (ještě silnější než manganistany). Oxidují například amoniak již za studena přímo na dusík a samy se redukují na železitou sůl. V kyselém prostředí přechází železany za vývoje kyslíku na železitou sůl. V prostředí koncentrovaného hydroxidu přecházejí železany na železičitany za současného odštěpování kyslíku.
Komplexní sloučeniny
Oxidační stav III (d5)
Železité komplexy mohou být (na rozdíl od ruthenitých a osmitých) vysokospinové (častěji) i nízkospinové (s bipyridylen (bipy), fenanthrolinem (phen) a kyanidovými aniony). Většina komplexů má oktaedrické uspořádání, ale mohou se objevovat i jiná. Komplexy FeIII nejsou příliš stabilní a mají tendenci se redukovat. Trojmocné železo tvoří řadu jednoduchých kationtů a ty tvoří soli s anionty, které nemají např. jako jodidy redukční schopnosti. Soli se dají získat z roztoků v podobě krystalických světle růžových nebo světle fialových hydrátů s hexaaquaželezitým kationtem [Fe(H2O)6]3+. Je rovněž přítomen v kamencích [MI(H2O)6][Fe(H2O)6](SO4)2, které se používají v barvířství jako mořidla. Nejlevnější solí je síran železitý Fe2(SO4)3•n H2O, který se vyskytuje jako 3, 6, 7, 9, 10 a 12-hydrát. Nejčastější je nonahydrát, který se používá jako kolagulační činidlo při úpravě pitné vody a čištění městských a průmyslových odpadních vod. Pokud při krystalizaci z roztoků nedodržíme nízké pH, dochází ke hydrolýze za vzniku žlutých produktů, které znečišťují vylučující se sůl. Ke hydrolýze dochází také při rozpouštění železitých solí a žlutá barva roztoku se následně mění na hnědou. Tyto roztoky jsou poměrně kyselé. Při vyšším pH se vylučuje červenohnědá sraženina hydratovaného oxidu železitého Fe2O3•n H2O. FeIII dává přednost kyslíkatým ligandům před dusíkatými. Amonné komplexy nejsou stabilní a ve vodném roztoku disociují. Mnohem stálejší jsou chelátotvorné komplexy (ligand s více donorovými elektrony) jako jsou například bipyridyl (bipy) a fenanthrolin (phen) (nízkospinové). Tyto sloučeniny však nejsou tak stabilní jako jsou analogické sloučeniny železnaté. Např. tmavé červený [Fe(phen)3]2+ je ve vodném roztoku velice stálý, zatímco tmavě modrý [Fe(phen)3]3+ se hydrolyzuje za vzniku polymerních hydroxo-částic a roztok mění barvu na khaki. S fenoly nebo enoly dává FeIII intenzivní zbarvení, což slouží jako důkaz těchto sloučenin. Přidáním kyseliny fosforečné do žlutého roztoku FeCl3 vznikají bezbarvé komplexy [Fe(PO4)3]6- a [Fe(HPO4)3]3-. Dalšími komplexy s kyslíkatými donory jsou zelené oxalatoželezitany [Fe(C2O4)3]3- a tmavě červený [Fe(acac)3]. Oxalatoželezitany jsou sice stálé vůči disociaci, ale jsou fotosensitivní a rozkládají se na Fe(C2O4)2 a CO2. Známé jsou i komplexy s ligandy obsahující kyslíkové i dusíkové donorové atomy, např. EDTA a Schiffovy báze. V [Fe(H2O)(edta)]- je koordinační číslo 7 (pentagonální bipyramida) a v [FeCl(salen)] koordinační číslo 5 (čtvercová pyramida). Stálost halogenidových komplexů klesá od fluoru k bromu (komplexy jodu neexistují). Nejstálejší jsou fluoroželezitany, nejčastěji [Fe(H2O)F5]2-, ale existují i komplexní sloučeniny typu [FeF6]3-, a [FeF4]-. Chloroželezitany se častěji vyskytují v tetraedrickém uspořádání [FeCl4]- a méně častý je [FeCl5]2-. Bromoželezitany [FeBr4]- jsou tepelně nestálé vlivem redoxních procesů (FeII a Br2). Charakteristické krvavě červené zbarvení dávají železité soli po přidání SCN-. Způsobují ho vznikající thiokyanatoželezitany (rhodanoželezitany) [Fe(SCN)6]3-, [Fe(SCN)4]-, Fe(SCN)3 a převládající [Fe(H2O)5(SCN)]2+. Nejznámější nízkospinové komplexy jsou kyanoželezitany [Fe(CN)6]3-. Patří sem např. červená krevní sůl (hexakyanoželezitan draselný, ferrikyanid draselný) K3[Fe(CN)6], který se získává oxidací [Fe(CN)6]4- např. chlorem. Kyanidové ligandy jsou však vázány natolik slabě, že jsou hexakyanoželezitany toxické. Má také nízké oxidační účinky. Se solemi Fe+2 poskytují modrou sraženinu, nazývanou Turnbullova modř. Tato reakce je jedním z analytických důkazů přítomnosti dvojmocného železa ve vzorku. Železité komplexy s pěti kyanidovými ligandy a jedním jiným se nazývají prussidy. Z [Fe(CN)6]3- můžeme působením zředěných kyselin připravit [Fe(H2O)(CN)5]2-. Nejznámější je ale nitroprussid sodný Na2[Fe(CN)5(NO)]. Nitroprussidy slouží k důkazu S2- za vzniku červeného [Fe(CN)5(NOS)]4-.
Oxidační stav II (d6)
Železnaté komplexy jsou na rozdíl od železitých velmi stabilní a tvoří komplexní soli téměř se všemi anionty (až na dusitanový (redukce na NO), bromičnanový a jodičnanový anion). Tyto roztoky obsahují hexaaquaželeznaté kationty [Fe(H2O)6]2+, který se také vyskytuje např. v Fe(ClO4)2 • 6 H2O, FeSO4 • 7 H2O (zelená skalice) a (NH4)2SO4 • FeSO4 • 7 H2O (Mohrova sůl používaná v odměrné analýze). Železnaté soli nepodléhají hydrolýze, po přidání CO32- se tak sráží FeCO3, který se na vzduchu následně oxiduje. Pokud je CO2 v nadbytku, vzniká rozpustný Fe(HCO3)2. Jeho výskyt v minerálních vodách způsobuje vylučování FeCO3, který se oxiduje na hydratované oxidy železité Fe2O3•n H2O (hnědé sraženiny). Problém železnatých solí je jejich snadná oxidace (nejčastěji vzdušným kyslíkem) na železité sloučeniny, které nejsou zase stabilní v roztoku. Stálost vůči oxidaci na železité sloučeniny vykazují některé podvojné sloučeniny - zejména sírany, např. zmíněná Mohrova sůl. Železnatý kation vykazuje, na rozdíl od železitého, výraznější sklon ke tvorbě komplexů s dusíkatými ligandy a výrazně menší sklon k tvorbě ligandů s kyslíkatými ligandy. Např. existuje [Fe(NH3)6]2+ a méně stále komplexy s acac a šťavelanovým aniontem. Převážná většina železnatých komplexů je oktaedrická. K tetraedrickým komplexům patří komplexy s chlorem, bromem, jodem a rhodanidem [FeX4]2-. Železnaté komplexy jsou častěji vysokospinové, nízkospinové komplexy tvoří železo pouze s bipyridylen (bipy), fenanthrolinem (phen) a kyanidovými anionty. [Fe(bipy)3]2+ a [Fe(phen)3]2+ jsou intenzivně červeně zbarvené. Druhý jmenovaný komplex slouží v analytické chemii jako redoxní indikátor ferroin, protože se při styku s oxidačním činidlem oxiduje na modrý [Fe(phen)3]3+. Vysokospinové mono- a bisfenathrolinové komplexy lze připravit obtížně.
Mezi nejznámější kyanoželeznatany [Fe(CN)6]4- patří světle žlutý hexakyanoželeznatan draselný K4[Fe(CN)6] (žlutá krevní sůl, ferrokyanid draselný). Dříve se připravoval tavením dusíkatých živočišných zbytků (kůže, rohy, atd.) se železem a K2CO3. Je netoxický a dobře rozpustný ve vodě. Se solemi Fe+3 poskytují intenzivně modrou sraženinu, nazývanou berlínská modř. Tato reakce je jedním z analytických důkazů přítomnosti trojmocného železa ve vzorku. Oxalatoželeznatany jsou komplexní sloučeniny s obecným vzorcem M2I[Fe(C2O4)2]
Nižší oxidační stavy
Komplexy v nižších oxidačních číslech se podařilo připravit s karbonyly železa a to zejména Fe2-. Pentakarbonyl železa Fe(CO)5 je kapalná látka, vznikající tlakovým zahříváním práškového kovového železa v atmosféře oxidu uhelnatého. Je nestálá toxická sloučenina, která se využívá k přípravě velmi čistého železa – lze ji snadno destilačně oddělit od solí ostatních kovů.
Organické sloučeniny
Železo je biogenním prvkem a je také součástí organokovových sloučenin železa.[17] Nejdůležitější biogenní a zároveň organokovovou sloučeninou železa je bezpochyby hemoglobin, který přenáší kyslík v krvi a udržuje tak celý organismus při životě před vnitřním zadušením. K významným sloučeninám železa však také patří soli organických kyselin a karbonyly železa (viz výše).
- Šťavelan železnatý FeC2O4 je žlutá krystalická látka, nerozpustná ve vodě. V roztoku lze připravit i komplexní sloučeniny (viz výše) oxalatoželeznatany. Šťavelan železnatý se připravuje sražením železnatých solí v kyselinou šťavelovou. Používá se jako pigment.
- Šťavelan železitý Fe2(C2O4)3 je hnědá práškovitá látka, rozpustná ve vodě a nestálá na světle. Na světle se totiž šťavelan železitý redukuje na šťavelan železnatý. Šťavelan železitý v roztocích vytváří rozpustné komplexní sloučeniny (viz výše) oxalatoželezitany. Připravuje se rozpouštěním železa v kyselině šťavelové.
Biologický význam
Železo patří mezi tzv. mikrobiogenní prvky, které tvoří obvykle méně než 0,005% hmotnosti. V lidském těle se nachází asi 3 - 4 gramy železa. Z tohoto množství
- 65-70 % se nachází v molekulách hemoglobinu.
- 3-4 % v myoglobinu
- asi 1 % v enzymech (cytochromy, cytochromoxidasa, peroxidasa aj.)
- 0,1 % je tzv. transportní (plazmatické) železo, nejvíce ve vazně na transferrin
- 15-30 % připadá na zásobní železo, které je vázáno na bílkoviny (ferritin, hemosiderin)[18]
Příjem a výdej
Ztráty železa jsou asi 0,5-1 mg za den, u žen větší ztráty 1,5-2 mg mají příčinu v menstruaci. Podíl vstřebaného železa je pouze 3 - 6%. Doporučená denní dávka je 20 mg.[19] Minimální denní přívod železa nezbytný pro červenou krvetvorbu je 10 - 15 mg. Hlavním zdrojem železa v potravě je maso, především vnitřnosti jako játra, srdce a slezina. Zdrojem železa jsou ale i luštěniny, listová zelenina a některé ovoce jako například jahody. Příjem železa v iontové formě (Fe+2 a Fe+3) není pokládán za optimální, především ion Fe+3 je značně rizikový. Celkový maximální obsah v pitné vodě je normativně omezen na maximálně 0,2 ppm (mg/l)[20][21] č. 252/2004 Sb..
Železo v hemoglobinu
Organokovová komplexní sloučenina hemoglobin hraje totiž klíčovou roli v transportu kyslíku z plic do tělesných tkání a je proto nezbytná pro dýchání. Chemicky je hemoglobin tvořen porfyrinovým skeletem složeným ze 4 pyrrolových jader, jejichž dusíkové atomy směřují do středu kruhu a komplexně váží atom železa. Porfirinová struktura je v přírodě velmi běžná, zelené rostlinné barvivo chlorofyl s porfirinovým skeletem má za centrální atom hořčík a s jeho pomocí produkují rostliny kyslík (fotosyntéza) a současně přeměňují energii slunečního záření na energeticky využitelné organické sloučeniny sacharidy. Hlavním nositelem hemoglobinu v krvi jsou červené krvinky, které fungují jako přenašeč kyslíku z plic do organizmu. Důležitý je fakt, že vazebná energie mezi atomem železa a molekulou kyslíku je relativně značně nízká a tak může hemoglobin v tkáních s nízkým obsahem kyslíku uvolňovat jeho molekulu a naopak v plicních sklípcích bohatých kyslíkem molekulu kyslíku vázat a transportovat dále. Porucha přenosu kyslíku nastává v případě, že se do plic dostane molekula s podobnými vazebnými charakteristikami jako kyslík. Nejběžnějším případem je zde oxid uhelnatý CO, který se váže na hemoglobin stejně ochotně jako kyslík, energie této vazby je však větší a dochází tak k zablokování přenosu kyslíku díky nevratném obsazení molekul hemoglobinu oxidem uhelnatým. Protože komplexní sloučenina CO s hemoglobinem má intenzivně červenou barvu, projevuje se otrava oxidem uhelnatým zčervenáním sliznic postižené osoby. Metabolické příčiny snížené tvorby červeného krevního barviva jsou obvykle vyvolány nedostatkem železa v přijímané potravě, ale nízké množství hemoglobinu může být způsobeno i vysokou ztrátou krve při úrazu, porodu apod. Navenek se tento stav projevuje chorobnou bledostí a zvýšenou únavou postiženého, medicínsky je tento stav označován jako chudokrevnost neboli anémie. Zvýšené riziko anémie nastává především u žen při porodu, ale částečně i při běžné menstruaci.
Železo v rostlinnách
Stejně jako ostatní minerály, i železo rostlina přijímá s vodou z půdy. Fe3+ ionty v půdě jsou obtížně rozpustné, proto rostlina vylučuje do svého okolí organické látky, které s železem reagují a tvoří cheláty. Tyto cheláty se vážou na membřánu, na které se železo redukuje z Fe3+ na Fe2+ Fe3+chelátreduktasou. Fe2+ pak vstupuje do buňky.U poaceae se vylučované látky nazývají fytosiderofory a skrz membránu procházejí neredukované Fe3+ ionty. Fytosiderofory jsou případem fytometaloforů, neboť takto lze přijímat i jiné kovy. Železo se dále transportuje xylémem. Skladováno je ve fytoferitinu, což je proteinový obal, obalující 5000 - 6000 iontů železa. Nedostatek železa způsobuje světlé skvrny na listech, přebytek jejich bronzový nádech.
Literatura
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- GREENWOOD, N. N; EARNSHAW, A. Chemie prvků II. 1. čes. vyd. Praha : Informatorium, 1993. ISBN 80-85427-38-9. S. 1320–1374.
- Jursík F.: Anorganická chemie kovů. 1. vyd. 2002. ISBN 80-7080-504-8 (elektronická verze)
Reference
- ↑ 1,0 1,1 1,2 Chemie prvků II (viz literatura), strana 1320.
- ↑ 2,0 2,1 Childe V. G.: What Happend in History, Penguin Books, Londýn 1942, str. 182
- ↑ 3,0 3,1 Pleiner, R. (2000) Iron in Archaeology, The European Bloomery Smelters, Praha, Archeologický Ústav AV ČR.
- ↑ 4,0 4,1 4,2 4,3 4,4 Chemie prvků II (viz literatura), strana 1321.
- ↑ 5,0 5,1 5,2 Chemie prvků II (viz literatura), strana 1324.
- ↑ Překlad anglického popisku na stránce uvedeného obrázku.
- ↑ Kirk-Othmer Encyklopedia of Chemical Technology, 3. vydání, Vol. 13. Interscience, New York 1981, str. 735
- ↑ Finniston M. : Ther Technological Feature Feature of Steel Industry, Chem. Ind. 1976, 501
- ↑ 9,0 9,1 9,2 Chemie prvků II (viz literatura), strana 1322.
- ↑ 10,0 10,1 10,2 10,3 Atomic weights of the elements. Review 2000 (IUPAC Technical Report) (anglicky) (Procentuální zastoupení je zaokrouhleno na dvě desetinná místa).
- ↑ Atomic weights of the elements. Review 2000 (IUPAC Technical Report) ("It is of interest to note that 56Fe has a larger mass defect than any other nuclide.")
- ↑ Dauphas, N. & Rouxel, O. 2006. Mass spectrometry and natural variations of iron isotopes. Mass Spectrometry Reviews, 25, 515-550
- ↑ Nicholls D.: Iron, in: Comprehensive Inorganic Chemistry, Vol. 3. Pergamon Press, Oxford 1973. Kap. 40, str. 979
- ↑ Rao C. N. R., Rao G. V. S.: Transition Metal Oxides. National Standard Reference Data System NSRDS-NBS49. Washington 1964. str. 130
- ↑ Crangle J.: The Magnetic Properites of Solids. Arnold, Londýn 1977, str. 194
- ↑ Wells A. F.: Structural Inorganic Chemistry. 4. vydání Oxford University Press, Oxford 1975. Kap. 13, str 476
- ↑ Griffith W. P.: Carbonyls, Cyanides, Isocyanides and Nitrosyls. in: Comprehensive Inorganic Chemistry. Vol. 4. Pergamon Press, Oxford 1973. Kap. 46, str. 105 - 95
- ↑ Ganong, Wiliam F.: Přehled lékařské fysiologie, Nakladatelství a vydavatelství H&H, Jinočany 1999.s.402.
- ↑ Ganong, Wiliam F.: Přehled lékařské fysiologie, Nakladatelství a vydavatelství H&H, Jinočany 1999.s.402.
- ↑ Iron in Model and Natural Compounds. Metal Ions in Biological Systems (Sigel H. Ed.) Vol. 7. Marcel Dekker, New York 1978, str. 417
- ↑ Perutz M. F.: Stereochemistry of Cooperative Effects in Hemoglobin. Nature 228, 726 (1970)
Externí odkazy
- Ordinace - železo Biologický význam železa
- Zdravocenta - železo Železo v potravě
- Hutnictví železa Historie ocelářství
- Agrokom Výživa a hnojení rostlin
- Stará huť Vlastnosti železa
- Zpracování železa Počátky hutnictví železa
- Celkové zdraví Metabolismus železa
- Maturita Sloučeniny a slitiny železa
- Aquar Železo ve vodě
- Eurochem Vlastnosti, analytické stanovení, toxikologie
- WebElements.com – Iron (en)
- It's Elemental – Iron (en)
- The Most Tightly Bound Nuclei (en)
- Eisengewinnung im Hochofen (de)
- die-roemer-online.de (de)
- Eisengewinnung in vorgeschichtlicher Zeit (de)
- Nachhaltige Eisengewinnung früher, mit Lehmofen und Raseneisenerz (de)
- Hochofenmuseum Radwerk IV (de)
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |