Návštěvnost dne 25. února 2026 byla — 484 927 unikátních návštěvníků !
Návštěvnost dne 26. února 2026 byla — 479 665 unikátních návštěvníků !
Návštěvnost dne 5. března 2026 byla — 475 445 unikátních návštěvníků !
Ozon
Z Multimediaexpo.cz
| Ozón | |
| |
| Registrační číslo CAS | 10028-15-6 |
| Sumární vzorec | O3 |
| Molární hmotnost | 48,00 g/mol |
| Teplota tání | −191,98 °C |
| Teplota varu | −111,9 °C |
| Kritická teplota | −12 °C |
| Kritický tlak | 5,4 MPa |
| Hustota | 2,144 g/dm3 (0 °C), plynné skupenství |
| Rozpustnost ve vodě | 10 mg/l |

Ozon (racionální chemický název trikyslík) je alotropní modifikace kyslíku.
Kromě obvyklých dvouatomových molekul O2 se kyslík vyskytuje i ve formě tříatomové molekuly jako ozon O3. Za normálních podmínek je to vysoce reaktivní plyn modré barvy a charakteristického zápachu s mimořádně silnými oxidačními účinky. Při teplotě -112 °C kondenzuje na kapalný tmavě modrý ozon a při -193 °C se tvoří červenofialový pevný ozon. Z řeckého οζω, ozó, voním, podle intenzivního zápachu v nepatrných koncentracích.
Obsah |
Vlastnosti a vznik
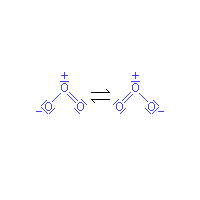
Molekuly ozonu se stávají ze tří atomů kyslíku namísto dvou, které tvoří molekuly stabilního běžného kyslíku. Molekula ozonu je lomená a úhel, který svírají vazby mezi atomy kyslíku, je 116,8°. Jak naznačují mesomerní strukturní vzorce (viz infobox), představující mezní elektronové konfigurace této molekuly, je na prostředním atomu kladný náboj, zatímco na obou krajních je záporný náboj poloviční velikosti. Díky tomu a svému lomenému tvaru má molekula značný dipólový moment. Přítomnost dipólového momentu přispívá k zesílení van der Waalsových mezimolekulových přitažlivých sil a spolu s vyšší hmotností molekuly ke snížení těkavosti ozonu ve srovnání s kyslíkem. Ozon vzniká působením elektrických výbojů nebo krátkovlnného ultrafialového záření (například UV-C) na molekuly obyčejného kyslíku, přičemž tato reakce probíhá ve dvou stupních. V prvním dodaná energie rozštěpí dvouatomovou molekulu dikyslíku na dva atomy, tedy na dva vysoce reaktivní jednoatomové radikály, které se okamžitě spojí s další molekulou dikyslíku za vzniku ozonu:
- O2 + hν → 2 O,
- O2 + O → O3.
Při normální teplotě a tlaku je ozon namodralý plyn s intenzivním pachem, který člověk registruje již při koncentraci 2 ppm. Při ochlazování se nejprve přeměňuje na tmavě modrou kapalinu, a posléze v tmavě modrou pevnou látku. Ozon je silné oxidační činidlo. Je nestabilní a reakcí
- 2O3 → 3O2
se rozkládá na obyčejný kyslík. Průběh reakce se zrychluje se stoupající teplotou a klesajícím tlakem. Přeměnu ozonu na kyslík urychlují také některé chemické sloučeniny a radikály, například atomy fluoru a chloru (viz heslo ozonová vrstva). Ve vysokých koncentracích je jedovatý. Protože v lidském těle způsobuje tvorbu volných radikálů, je pro člověka a některé živočichy karcinogenní. U řady druhů bakterií byla pozorována při nízkých koncentracích i mutagenicita ozonu, ve vyšších koncentracích ozón mikroorganismy zabíjí.
Výskyt v přírodě
Troposférický ozon
- Podrobnější informace naleznete na stránce: Troposférický ozon
Ozon je minoritní složkou nízké atmosféry, zejména fotochemického smogu. Troposférický ozon vzniká složitými chemickými reakcemi oxidů dusíku s těkavými organickými sloučeninami za horkých letních dnů a bezvětří, a to především v městských a průmyslových oblastech.[1] V Evropské unii je podle Evropské agentury pro životní prostředí nadlimitním koncentracím ozónu vystaveno 6 z 10 obyvatel evropských měst. V rozsáhlých oblastech střední a jižní Evropy koncentrace překračují kritické hodnoty pro negativní účinek na lesy a zemědělské plodiny [2](odplavuje chlorofyl z listů). Opakem životu prospěšného ozonu ve stratosféře je tzv. přízemní neboli troposférický ozon, vyskytující se těsně nad zemským povrchem. Tento plyn je lidskému zdraví nebezpečný, působí dráždění a nemoci dýchacích cest, zvyšuje riziko astmatických záchvatů, podráždění očí a bolest hlavy. Zvýšený vznik přízemního ozonu pozorujeme především za slunečných horkých letních dnů v lokalitách s vysokou koncentrací výfukových plynů - oxidů dusíku a těkavých organických látek v ovzduší. Tento jev se souhrnným názvem označuje jako suchý smog, někdy také fotochemický smog nebo losangelský smog (podle místa častého výskytu). V Evropské unii je podle Evropské agentury pro životní prostředí nadlimitním koncentracím ozónu vystaveno 6 z 10 obyvatel evropských měst. V rozsáhlých oblastech střední a jižní Evropy koncentrace překračují kritické hodnoty pro negativní účinek na lesy a zemědělské plodiny.[3] Elektronová konfigurace: 1s2, 2s2, 2p4.
Ozonová vrstva
- Podrobnější informace naleznete na stránce: Ozonová vrstva

Vyšší koncentrace v rozsahu 2 až 8 ppm v atmosféře se nacházejí v stratosféře, ležící ve výškách mezi 10 až 50 km, která zachycuje většinu ultrafialového záření (UV-B) přicházejícího ze Slunce. Kdyby se veškerý ozon ve stratosféře stlačil při tlaku cca 1000 hPa (1 atmosféru), vytvořil by vrstvu tenkou 3,5 mm. Mimořádně významnou roli pro pozemský život hraje ozonová vrstva atmosféry, která chrání planetu před ultrafialovým slunečním zářením. Je to část stratosféry ve výšce 25 – 35 km nad zemským povrchem, v níž se nachází značně zvýšený poměr ozonu vůči běžnému dvouatomovému kyslíku.
Endogenní ozon
Kromě toho je ozon v těle teplokrevných živočichů produkován v bílých krvinkách a uvolňován do krve a tkání, čímž pomáhá při likvidaci choroboplodných zárodků.
Zdravotní rizika
Ozon jako silné oxidační činidlo může reagovat s celou škálou biologicky významných látek a způsobuje vznik peroxidů polynenasycených mastných kyselin a aminokyselin enzymů a koenzymů atd. Proto působí negativně na buněčné membrány.[4] Vdechování ozonu vyvolává pokles kapacity plic v závislosti na jeho koncentraci a na hloubce dýchání.[5] Podle Světové zdravotní organizace (WHO) vdechování ozónu vede ke vzniku zánětlivých onemocnění plic, narušení vývoje plic a snížení jejich funkce. Zvyšuje počet hospitalizací, způsobuje vyšší spotřeba léčiv a zvýšenou úmrtnost.[6]
Použití
V chemických laboratořích slouží jako oxidační činidlo, zejména v organické syntéze a při přípravě některých peroxidických sloučenin. V průmyslu se používá především k bělení (například textilních látek), při dezinfekci, zejména vody[7], kde ozonizace nahrazuje běžnější a lacinější, ale zdravotně méně výhodné chlorování pitné vody, v potravinářském průmyslu k dezinfekci provozoven a k povrchové konzervaci potravinářských výrobků a v zemědělství k povrchovému ošetření zeleniny a ovoce (zejména zabránění růstu plísní a kvasinek). Směs asi 10 % kapalného ozonu a 90 % kapalného kyslíku byla v průběhu 50. let 20. století testována jako okysličovadlo v raketových kapalinových motorech pro zvýšení specifického impulsu. Směs byla značně nebezpečná a proto nebyla nikdy prakticky použita. Ozon je velmi silné oxidační činidlo.[8]. Jeho desinfekční vlastnosti jsou vynikající, protože má mimořádně velkou mikrobiocidní účinnost. Ozon v případě kontaktu s živou tkání v přiměřených koncentracích tuto tkáň ozdravuje, prokrvuje a také velmi důkladně dezinfikuje. Využívá se v medicíně například pro léčbu akné, atopických ekzémů a dalších kožních defektů[9]. V posledních letech se ozónu využívá ve stomatologii v Ozonoterapii[10]. 2H2O2 → O2+2H2O Poměrně snadno lze připravit ozon tichým elektrickým výbojem v atmosféře čistého kyslíku. Vzniká tak směs kyslíku s ozonem, kde podíl O3 dosahuje obvykle 10%. Čistý ozon lze pak připravit frakční destilací této plynné směsi. Praktické využití ozonu je dáno jeho silnými oxidačními účinky.
- V medicíně slouží ke sterilizaci nástrojů. Poněkud diskutabilní jsou účinky dnes poměrně populární ozonové terapie, která by podle svých zastánců měla vést k regeneraci buněk a tkání.. Odpůrci této metody poukazují na možná rizika podobných omlazovacích kůr, daná především vysokou reaktivitou i toxicitou ozonu.
- Baktericidní účinky ozonu se někdy využívají k dezinfekci pitné vody namísto plynného chloru, chlornanů, chloraminu nebo oxidu chloričitého, případně jako první fáze před použitím uvedených látek (tzv. preozonizace). Výhodou je, že i při malých dávkách inaktivuje i parazitické prvoky, a také že oxiduje organické látky, aniž by docházelo k tvorbě karcinogenních trihalomethanů.[11]
- Silné oxidační účinky ozonu se velmi často využívají v papírenském průmyslu k bělení celulózy pro výrobu papíru.
Historická poznámka
Poprvé pozoroval zápach ozonu při pokusech s elektrickými jiskrami v roce 1785 nizozemský vědec Martinus van Marum. Jeho objev byl zapomenut, a ozón znovuobjevil v roce 1839 německý chemik Christian Friedrich Schönbein. Pokládal jej za nový prvek a dal mu jméno ozon. Pravou podstatu ozonu odhalili v roce 1845 francouzští vědci Auguste de la Rive a Jean-Charles de Marignac, kteří správně předpokládali, že se jedná jen o novou formu běžného kyslíku. Jejich teorii dokázal angličan Thomas Andrews v roce 1856.
Související články
Literatura
- Směrnice pro kvalitu ovzduší v Evropě, Ministerstvo životního prostředí ČR, Praha 1996, ISBN 80-7212-000-X
- Jaroslav Kadrnožka: Energie a Globální oteplování, Země v proměnách při opatřování energie (obsahuje kapitolu věnovanou ozonu a ozónové vrstvě), BEN 2006, ISBN 80-214-2919-4
- Donella Meadows: Překročení mezí, Argo, 1992, ISBN 80-85794-83-7 (obsahuje případovou studii, vysvětlující koloběh ozonu a vývoj jeho stavu)
- Miroslav Šuta: Účinky výfukových plynů z automobilů na lidské zdraví, Děti Země 2008, ISBN 80-86678-10-5
Reference
- ↑ Přízemní ozon zabíjí. Loni ohrožoval 85 procent Čechů
- ↑ Miroslav Šuta: Český vzduch? Jeden z nejšpinavějších v Evropě, respekt.cz, 14. listopadu 2007
- ↑ Miroslav Šuta:Český vzduch? Jeden z nejšpinavějších v Evropě, respekt.cz, 14. listopadu 2007
- ↑ Směrnice pro kvalitu ovzduší v Evropě, Ministerstvo životního prostředí ČR, Praha 1996, ISBN 80-7212-000-X
- ↑ Miroslav Šuta: Účinky výfukových plynů z automobilů na lidské zdraví, Děti Země 2008, ISBN 80-86678-10-5
- ↑ Miroslav Šuta: Český vzduch? Jeden z nejšpinavějších v Evropě, respekt.cz, 14. listopadu 2007
- ↑ OZON V MODERNÍCH TECHNOLOGIÍCH ÚPRAVY PITNÉ VODY
- ↑ Ozone - PubChem Public Chemical Database
- ↑ Sen sa stáva skutočnosťou - ozon v stomatológii
- ↑ Ozone Dental Therapy
- ↑ Doc. RNDr. Jiří Dřímal: Ozon v moderních technologiích úpravy pitné vody
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |
