Multimediaexpo.cz je již 18 let na českém internetu !!
Methan
Z Multimediaexpo.cz
Methan (mimo chemii dle PČP metan) neboli podle systematického názvosloví karban je nejjednodušší alkan a tedy i nejjednodušší uhlovodík vůbec. Při pokojové teplotě je to netoxický plyn bez barvy a zápachu, lehčí než vzduch (relativní hustota 0,55 při 20 °C).
Obsah |
Příprava
Hlavním zdrojem methanu je přírodní surovina zemní plyn. Přímá příprava sloučením uhlíku s vodíkem je prakticky nemožná, vzhledem k tomu, že by uhlík musel být nejprve převeden do plynného stavu. Teoreticky však lze methan připravit dvoustupňovou syntézou přes sirouhlík
- C + 2 S → CS2,
který pak reakcí se sulfanem (sirovodíkem) a mědí dá methan
- CS2 + 2 H2S + 8 Cu → CH4 + 4 Cu2S.
Jinou možností je reakce karbidu hliníku s vodou
- Al4C3 + 12 H2O → 3 CH4 + 4 Al(OH)3.
Laboratorně se dá připravit žíháním směsi octanu sodného s hydroxidem sodným (natronovým vápnem)
- CH3COONa + NaOH → CH4 + Na2CO3.
Vlastnosti
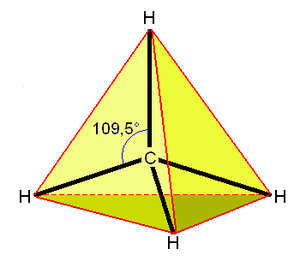
Molekula methanu má symetrii pravidelného čtyřstěnu (bodová grupa symetrie Td), v jehož těžišti se nachází uhlíkový atom a v jehož vrcholech se nacházejí vodíkové atomy. Díky této vysoké symetrii je celkově molekula methanu nepolární, přestože vazby H–C slabou polaritu vykazují. Methan může reagovat explozivně s kyslíkem
- CH4 + 2 O2 → CO2 + 2 H2O.
Bod samozážehu je sice velmi vysoký (595 °C, teplota vznícení při koncentraci 8,5 % je 537 °C), ale stačí např. elektrická jiskra nebo otevřený plamen a směs methanu se vzduchem může být přivedena k výbuchu (minimální iniciační energie je 0,28 mJ). Přitom meze výbušnosti jsou značně velké, od 4,4 do 15 objemových procent. Proto je nezbytně nutné průběžně sledovat koncentraci methanu (důlního plynu) v uhelných dolech, aby se předešlo katastrofám. Podobně prudce může methan reagovat i s plynným chlórem, je-li reakce iniciována prudkým zahřátím. Za normální teploty probíhá pomalu čtyřstupňově za vzniku chlorovaných derivátů methanu
- CH4 + Cl2 → CH3Cl + HCl,
- CH3Cl + Cl2 → CH2Cl2 + HCl,
- CH2Cl2 + Cl2 → CHCl3 + HCl,
- CHCl3 + Cl2 → CCl4 + HCl.
Podobně reaguje i s jinými halogeny. Jinak je málo reaktivní.
- Dokonalé hoření methanu
CH4 + 2O2 → CO2 + 2H2O
- Nedokonalé hoření methanu
CH4 + O2 → 2H2O + C nebo 2CH4 + 3O2 → 4H2O + 2CO
Výskyt v přírodě
Methan se přirozeně vyskytuje na Zemi:
- v atmosféře, kam se dostává zejména jako produkt rozkladu látek biogenního původu (bioplyn), nebo jako produkt metabolismu velkých přežvýkavců, také z termitišť a z rýžovišť.
- v podzemí:
- jako hlavní složka zemního plynu
- jako součást důlního plynu v dolech
- rozpuštěný v ropě
- rozpuštěný ve vodě některých jezer, zvláště v Africe (např. jezero Kivu mezi Rwandou a Kongem)
- tvoří bublinky pod ledem rozmrzajícího permafrostu, například na Sibiři
Přítomnost ve vesmíru
Ve vesmíru byl nalezen v plynných mračnech v mezihvězdném prostoru. Dále pak je součástí atmosfér velkých planet (Jupiter, Saturn, Uran a Neptun) sluneční soustavy. V pevném stavu je součástí tzv. ledových měsíců velkých planet a tvoří zřejmě nezanedbatelnou část hmoty transneptunických těles, případně je vysrážen ve formě ledu nebo jinovatky na jejich povrchu (např. Pluto). Byl také prokázán v komách komet.
Původ na Zemi
Na Zemi pochází asi 90% metanu z produkce živých organismů, menší část je způsobena geologickými aktivitami (např. tavením magmatu). Ve vesmíru však bez dalších podkladů nelze původ metanu prokázat.[1] Zprávy některých médií, které z objevu metanu usuzují na existenci života ve vesmíru, jsou proto považovány za nepodložené.[2]
Použití
Hlavní oblastí použití methanu je energetika, kde slouží ve směsi s jinými uhlovodíky jako plynné palivo. Experimentálně byl kapalný methan použit ve směsi s kapalným kyslíkem jako pohonná látka v raketových motorech. V chemickém průmyslu se používá především k výrobě oxidu uhličitého spalováním se vzduchem a při neúplném spalování k výrobě sazí, používaných jako plnidlo a barvivo v gumárenském průmyslu.
Ekologické účinky
Vzhledem k tomu, že silně absorbuje infračervené záření, patří mezi významné skleníkové plyny zvyšující teplotu zemské atmosféry (je přibližně 20× účinnější než oxid uhličitý),jeho obsah v atmosféře je asi devětkrát menší než u oxidu uhličitého (0,004% methanu a 0,037% oxidu uhličitého).[pozn. 1]
Poznámky
- ↑ Pro přehled účinnosti skleníkových plynů viz tabulka v hesle Skleníkový plyn
Reference
- ↑ BRANDEJSKÁ, Anna. Vědci znovu objevili metan na Marsu, mohl by znamenat život [online]. iDnes, 2009-01-15, [cit. 2009-01-18]. Dostupné online.
- ↑ KUBALA, Petr. Metan na Marsu není téma pro bulvár [online]. Česká astronomická společnost, 200-01-16, [cit. 2009-01-18]. Dostupné online.
Literatura
- Ibler Z. a kol.: Energetika technický průvodce, 2002 BEN - technická literatura, ISBN 80-7300-026-1
Související články
- Bioplyn
- Anaerobní digesce - proces produkce bioplynu
Externí odkazy
- Methane, CH4, Physical properties, safety
- Umweltlexikon
- Metanová časovaná bomba (o ekologických účincích metanu)
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |