Multimediaexpo.cz je již 18 let na českém internetu !!
Aminokyseliny
Z Multimediaexpo.cz
Verze z 29. 3. 2011, 14:47
| Biogenní aminokyseliny | |
|---|---|
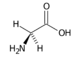 Glycin (Gly, G) | |
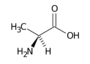 Alanin (Ala, A) | |
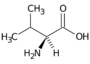 Valin (Val, V) | |
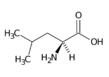 Leucin (Leu, L) | |
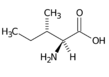 Isoleucin (Ile, I) | |
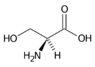 Serin (Ser, S) | |
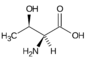 Threonin (Thr, T) | |
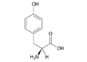 Tyrosin (Tyr, Y) | |
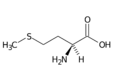 Methionin (Met, M) | |
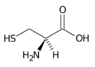 Cystein (Cys, C) | |
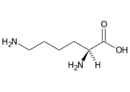 Lysin (Lys, K) | |
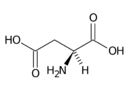 Kyselina asparagová (Asp, D) | |
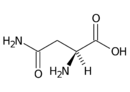 Asparagin (Asn, N) | |
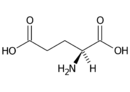 Kyselina glutamová (Glu, E) | |
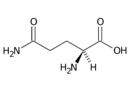 Glutamin (Gln, Q) | |
| Arginin (Arg, R) | |
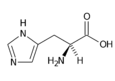 Histidin (His, H) | |
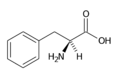 Fenylalanin (Phe, F) | |
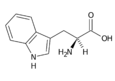 Tryptofan (Trp, W) | |
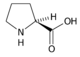 Prolin (Pro, P) | |
Aminokyselina je v chemii obecně jakákoliv molekula obsahující karboxylovou (-COOH) a aminovou (-NH2) funkční skupinu. V biochemii se většinou tímto termínem rozumějí pouze alfa-aminokyseliny, tj. takové, ve kterých jsou obě skupiny navázány na stejném uhlíkovém atomu. V ještě užším smyslu (například v molekulární biologii) se tímto pojmem většinou rozumí biogenní alfa-L-aminokyseliny – 20 základních stavebních složek všech proteinů (bílkovin).
Obsah |
Biogenní aminokyseliny
Až na nepatrné výjimky jsou všechny proteiny ve všech živých organismech sestaveny z pouhých 20 druhů aminokyselin. Ty se obvykle označují jako biogenní aminokyseliny nebo proteinogenní aminokyseliny. Posloupnost (sekvence) těchto aminokyselin určuje primární strukturu proteinu. Funkce proteinu závisí především na jeho terciární případně kvartérní struktuře, která je kromě sekvence aminokyselin dána mnoha dalšími faktory, např. okolním prostředím. Sekvence aminokyselin v proteinech je kódována (určena) deoxyribonukleovou kyselinou – DNA. Každá aminokyselina je v genetickém kódu kódována tripletem bazí a na pořadí těchto tripletů v DNA pak závisí pořadí aminokyselin v proteinu. Z cytoplazmy jsou dopravovány k ribozomu aminokyseliny navázané na tRNA, a to pomocí enzymů aminoacyl-tRNA syntetáz.
Vlastnosti aminokyselin
Reaktivita
Nositelem reakcí je karboxylová a aminová skupina. Aminokyseliny mohou tvořit soli, díky karboxylové skupině probíhá esterifikace, aminová skupina umožňuje acetylaci. Odstranění karboxylové skupiny se nazývá dekarboxylace, odstranění aminové skupiny pak deaminace. Důležitou reakcí během metabolismu aminokyselin je transaminace. Jde o přesun aminové skupiny z jedné molekuly na druhou, při němž z jedné aminokyseliny (např. alaninu) vzniká jiná (v tomto případě kyselina asparagová).
Peptidová vazba
Vznik peptidové vazby je reakce, při které reagují alfa-karboxylová skupina jedné aminokyseliny s alfa-aminovou skupinou druhé za odštěpení molekuly vody. Toto řetězení aminokyselin je principem spojování v peptidy a dále v proteiny (bílkoviny). Je to nejdůležitější reakce aminokyselin. K jejímu uskutečnění je třeba dodat energii.
Rozpustnost
Aminokyseliny se snadno rozpouštějí v polárních rozpouštědlech (voda, ethanol), v nepolárních rozpouštědlech jsou nerozpustné.
Náboj
Každá aminokyselina obsahuje aspoň dvě kyselé skupiny, které jsou schopné disociace: -COOH a -NH3+ a tvoří konjugované zásady -COO- a -NH2. V roztoku jsou kyselina i její konjugovaná zásada v protonové rovnováze:
- R-COOH ↔ R-COO− + H+
- R-NH3+ ↔ R-NH2 + H+
Jak se ustaví rovnováha, záleží na pH prostředí, tedy na koncentraci protonů v okolí. Karboxylová skupina je silnější kyselina a proton snadněji odštěpuje než přijímá. Při nízkém pH, kdy je koncentrace vodíkových iontů v roztoku vysoká, obě dvě skupiny váží proton. Při stoupajícím pH se nejprve uvolní proton vázaný v karboxylové skupině, protože ta má menší disociační konstantu: při pH krve (7,4) nebo cytoplasmy (7,1) existuje karboxylová skupina pouze jako karboxylátový iont R-COO−, zatímco aminoskupina je protonovaná kyselina R-NH3+. Vzniká tak amfiont, obojetný iont, který nese kladný i záporný náboj. Teprve je-li pH vysoké, uvolní se proton i z aminoskupiny a obě dvě funkční skupiny se nachází ve stavu konjugované zásady.
Izoelektrický bod
Izoelektrický bod je taková hodnota pH, při které má daná aminokyselina nulový volný elektrický náboj - nachází se ve formě amfiontu, který se nepohybuje v elektrickém poli. Izoelektrické pH u aminokyselin, které mají dvě disociovatelné skupiny, leží uprostřed hodnot pK na obou stranách izoiontového uspořádání:
- <math>\ pI = \frac{pK_1 + pK_2}{2} </math>
Situace je složitější u aminokyselin, které kromě alfa-karboxylové a alfa-aminové skupiny obsahují i jiné funkční skupiny, například kyselina asparagová, lysin nebo tyrosin.
Důkaz aminokyselin
Aminokyseliny se prokazují reakcí s ninhydrinem nebo fluorescaminem. Ninhydrin dekarboxyluje aminokyseliny na oxid uhličitý, amoniak a aldehyd, redukovaný ninhydrin pak reaguje se vzniklým amoniakem za vzniku modrého komplexu. Tato reakce je základem kvantitativního stanovení aminokyselin. Fluorescamin je citlivější činidlo, které umožňuje odhalit i nanogramová množství aminokyselin.
Aminokyseliny v živých organismech
Aminokyseliny jsou součástí proteinů a peptidů, tedy strukturních bílkovin, enzymů i mnoha hormonů. To ale není jejich jediná funkce, jsou potřeba jako dárci uhlíkových řetězců k syntéze porfyrinů, purinů nebo pyrimidinů, přímo se účastní syntézy močoviny. Jejich deriváty, biogenní aminy, slouží kromě jiného jako neurotransmitery při nervovém přenosu (dopamin, noradrenalin aj.) nebo jako látky, které ovlivňují růst buněk (spermin, spermidin) Rozkladem některých aminokyselin v odumřelých tělech organismů vznikají tzv. mrtvolné jedy - páchnoucí látky putrescin a kadaverin. Nadbytečné aminokyseliny, které nejsou hned zabudovány do proteinů, nejsou skladovány, ale jsou zbaveny dusíku a rozloženy. Při svém katabolismu poskytují uhlíkové kostry, které jsou dále zužitkovávány. Podle toho, do které metabolické dráhy vstupují a jaký může být jejich konečný produkt, se aminokyseliny dělí na aminokyseliny glykogenní, ketogenní a takové, které jsou glykogenní i ketogenní. Glykogenní aminokyseliny mohou být přeměněny na glykogen, ketogenní pak na tuk. V organismu neustále probíhá obnova proteinů a tedy i obměna jednotlivých aminokyselin. Aminokyseliny jsou syntetizovány de novo nebo přijímány s potravou; vyšší živočichové ztratili schopnost tvořit některé aminokyseliny a jsou závislí na jejich přísunu zvenčí - tyto esenciální aminokyseliny jsou nutnou součástí stravy. Rostliny a bakterie mají stále schopnost tvořit tyto aminokyseliny, protože u nich nacházíme metabolické dráhy, které živočichům chybějí - například šikimátová cesta k syntéze rozvětvených aminokyselin. Poruchy metabolismu aminokyselin jsou příčinou některých vrozených chorob, jako je fenylketonurie, tyrosinosa nebo nemoc javorového sirupu.
Aminokyseliny, které se vyskytují v proteinech
Kombinací těchto 20 (ve skutečnosti 21) biogenních aminokyselin jsou tvořeny všechny známé bílkoviny.
- Aminokyseliny s alifatickým postranním řetězcem
- S karboxylovou nebo amidovou skupinou na postranním řetězci (kyselé skupiny)
- Kyselina asparagová Asp (D)
- Asparagin Asn (N)
- Kyselina glutamová Glu (E)
- Glutamin Gln (Q)
- S aminovou skupinou na postranním řetězci (basické skupiny)
- S aromatickým jádrem nebo hydroxylovou skupinou na postranním řetězci
- Histidin His (H)
- Fenylalanin Phe (F)
- Serin Ser (S)
- Threonin Thr (T)
- Tyrozin Tyr (Y)
- Tryptofan Trp (W)
- Se sírou v postranním řetězci
- Iminokyseliny
- Prolin Pro (P)
21. aminokyselina
- Selenocystein SeCys – nahrazuje cystein v lidském enzymu glutathionperoxidáze a v enzymech některých bakterií[1]
| Aminokyseliny |
|---|
|
Alanin • Arginin • Asparagin • Cystein • Fenylalanin • Glutamin • Glycin • Histidin • Isoleucin • Kyselina asparagová • Kyselina glutamová • |
| Speciální aminokyseliny |
Reference
- ↑ KODÍČEK, M. selenocystein. From Biochemické pojmy : výkladový slovník [online]. Praha: VŠCHT Praha, 2007 [cit. 2008-10-21]. Dostupné z http://vydavatelstvi.vscht.cz/knihy/uid_es-002/ebook.html?p=selenocystein
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |
