Uhlík
Z Multimediaexpo.cz
(+ FLICKR) |
(++) |
||
| Řádka 179: | Řádka 179: | ||
{{Flickr|Carbon}}{{Commonscat|Carbon}}{{Tabulka prvků}}{{Biogenní látky}}{{Článek z Wikipedie}} | {{Flickr|Carbon}}{{Commonscat|Carbon}}{{Tabulka prvků}}{{Biogenní látky}}{{Článek z Wikipedie}} | ||
| + | [[Kategorie:Uhlík| ]] | ||
[[Kategorie:Chemické prvky]] | [[Kategorie:Chemické prvky]] | ||
Verze z 15. 6. 2022, 13:21
| Uhlík | |

| |
| Značka a latinský název | C, Carboneum |
| Stabilní izotopy | 12,13 |
| Relativní atomová hmotnost | 12,0107(8) amu |
| Elektronová konfigurace | 1s2 2s2 2p2 |
| Skupenství | Pevné |
| Teplota tání | 3527°C (3800 K) |
| Teplota varu | 4027 °C (4300 K) |
| Elektronegativita (Pauling) | 2,55 |
| Hustota | 2,267 g/cm3 (grafit) 3,513 g/cm3 (diamant) |
| Tvrdost | 0,5 (grafit) 10 (diamant) |
| Registrační číslo CAS | 7440-44-0 |
| Vzhled | 
|
Uhlík, chemická značka C, (lat. Carboneum) je chemický prvek, tvořící základní stavební kámen všech organických sloučenin a tím i všech živých organismů na této planetě. Sloučeniny uhlíku jsou jedním ze základů světové energetiky, kde především fosilní paliva jako zemní plyn a uhlí slouží jako energetický zdroj pro výrobu elektřiny a vytápění, produkty zpracování ropy jsou nezbytné pro pohon spalovacích motorů a tak silniční dopravu. Výrobky chemického průmyslu na bázi uhlíku jsou součástí našeho každodenního života ať jde o plastické hmoty, umělá vlákna, nátěrové hmoty, léčiva a mnoho dalších. V současné době bylo popsáno přibližně 10 milionů organických sloučenin.[1] [2]
Obsah |
Formy uhlíku
Elementární uhlík
Uhlík je typický nekovový prvek, který se v elementárním stavu jako minerál vyskytuje v přírodě ve dvou základních alotropních modifikacích a v posledních přibližně 20 letech byly laboratorně vytvořeny modifikace další:
- Grafit (starší název tuha) Struktura grafitu se skládá z vrstev, které jsou tvořeny uhlíky navázanými do šestiúhelníků. Na každý uhlík jsou vázany další tři uhlíky([[hybridizace3]] sp. Tvoří se zde rozsáhlý systém delokalizovaných elektronů| (pí -systém). Jednotlivé vrstvy spolu drží pouze pomocí slabých interakcí tzv. van der Waalsovy síly. Této vlastnosti se využívá např. při výrobě tužek, kde mletá tuha tvoří základní složku tyčinky určené pro psaní a kreslení. Grafit vede elektrický proud.
- Diamant je tvořen uhlíkem krystalizujícím v soustavě krychlové a je nejtvrdším[pozn. 1] a velmi cenným přírodním nerostem. Váha diamantů se udává v karátech, největším doposud nalezeným diamantem byl Cullinan, který v surovém stavu při nálezu v JAR dosáhl váhy 3 106 karátů. Diamanty se používají pro svou tvrdost a výbornou tepelnou vodivost (nikdy se nepřehřejí) v nejrůznějších řezných a vrtných nástrojích. Pro vysokou cenu bývají diamanty vyráběny synteticky.
- Lonsdaleit, též zvaný "šesterečný diamant", je velmi řídce se vyskytující alotropní modifikací uhlíku. Jeho krystalová struktura je tvořena podobně jako u diamantu atomy uhlíku vázanými jednoduchými kovalentními vazbami se čtyřmi sousedy, krystalová soustava je však šesterečná. Původ přírodního lonsdaleitu je vysvětlován přeměnou grafitu při dopadech meteoritů.[pozn. 2]
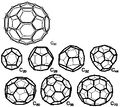
- Fullereny označují nově objevené sférické molekuly, složené z pěti nebo častěji šestičlenných kruhů atomů uhlíku. Prostorově jsou tyto molekuly uspořádány do kulovitého tvaru' a jsou mimořádně odolné vůči vnějším fyzikální vlivům. Zatím nejstabilnější známý fulleren je molekula, obsahující 60 uhlíkových atomů. Fullereny se uměle připravují pyrolýzou organických sloučenin laserem. Za objev a studium vlastností fullerenů byla v roce 1996 udělena Nobelova cena Robertu F. Curlovi a Richardu E. Smalleymu a Haroldu W. Krotoovi. V současné době je výzkum vlastností a metod přípravy fullerenů velmi intenzivně studován na řadě špičkových vědeckých institucí v celém světe.
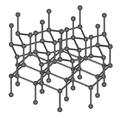
- Uhlíkové nanotrubice jsou uměle vyrobené mikroskopické trubičky složené z atomů uhlíku o tloušťce pouhých několika nanometrů. Perspektiva jejich využití se nabízí např. při výrobě velmi pevných a zároveň lehkých kompozitních materiálů a tkanin, v elektronice při výrobě mimořádně malých tranzistorů, jako ideálního materiálu pro uchovávání čistého vodíku pro palivové články a mnohé další.
- Grafen je forma uhlíku podobná grafitu. Tvoří jej rovinná síť několika vrstev vzájemně propojených atomů uhlíku uspořádaných do tvaru šestiúhelníků.
Anorganické sloučeniny
V anorganických chemických sloučeninách se uhlík vyskytuje v mocenství +2, +4 a -1.
- Z oxidů je důležitý především oxid uhličitý CO2, který se podílí na vytváření rostlinných tkání v procesu zvaném fotosyntéza a současně se vrací do atmosféry pří dýchání živých organizmů a spalování fosilních paliv.
- Ve vodě se CO2 rozpouští za vzniku velmi slabé kyseliny uhličité H2CO3. Známy jsou především soli této kyseliny - uhličitany (karbonáty), uhličitan vápenatý CaCO3 – vápenec a uhličitan hořečnatý MgCO3 – magnezit.
- Se sírou vytváří uhlík toxickou kapalnou sloučeninu - sirouhlík CS2.
- Oxid uhlíku s valencí +2, oxid uhelnatý CO je značně toxický plyn, který blokuje krevní barvivo hemoglobin a znemožňuje tak dýchání. Jeho nebezpečí spočívá především v tom, že je bezbarvý a bez zápachu a člověk proto jeho přítomnost v okolí nemůže poznat svými smysly. Byl příčinou mnoha smrtelných otrav v uhelných dolech nebo v domácnostech, kde se k topení používal svítiplyn.
- S dusíkem tvoří uhlík kyanidový ion CN- a kyanovodík HCN patří také k mimořádně toxickým látkám. V tomto případě však můžeme detekovat čichem jeho silný zápach po hořkých mandlích.
- S kovovými prvky tvoří uhlík sloučeniny zvané karbidy. Nejznámější je karbid vápenatý CaC2, který při reakci s vodou uvolňuje acetylen a byl dříve používán ke svícení v lampách, tzv. karbidkách. Poměrně známý je i karbid křemíku SiC neboli karborundum, který má krystalickou strukturu podobnou diamantu a vyznačuje se mimořádnou tvrdostí.
Organické sloučeniny
Hlavní článek: Organická sloučenina Organické sloučeniny jsou chemické látky, které obsahují alespoň jeden atom uhlíku a téměř vždy atom vodíku, převážná většina přitom má spolu vázané atomy uhlíku vazbou C-C. Každý atom uhlíku je schopen vytvářet celkem čtyři tyto tzv. jednoduché vazby, kromě toho i vazbu dvojnou C=C a vazbu trojnou C≡C. Mohou proto vznikat dlouhé řetězce a molekuly s rozvětvenou nebo cyklickou strukturou. Společně s uhlíkem se v těchto molekulách váží i další prvky, především biogenní prvky vodík, kyslík, dusík, síra a fosfor, ale mohou to být i halogeny, křemík a mnoho dalších. Díky tomu existuje nesmírně mnoho kombinací; v dnešní době je známo více než 10 milionů organických sloučenin. Jejich výčet je pravidelně registrován v Beilsteinově databázi, která shromažďuje souhnrná data o všech známých organických sloučeninách. Právě díky této obrovské rozmanitosti se organické látky staly základním stavebním kamenem živé hmoty. Každá buňka živého organismu obsahuje desetitisíce chemických sloučenin, které mají tu jedinou společnou vlastnost, že jejich základní skelet je tvořen atomy uhlíku v různých vazebných stavech. Následující výčet typů organických sloučenin není zdaleka úplný a měl by pouze podat informaci o nejčastěji používaných a vyráběných typech organických látek.
- Uhlovodíky jsou sloučeniny, které ve své molekule obsahují pouze atomy uhlíku a vodíku. Lze je v zásadě rozdělit na:Soubor:Ethyne-2D-flat.pngTrojná vazba v molekule acetylenu
- alifatické uhlovodíky, jejichž molekuly mají tvar řetězce a
- alicyklické uhlovodíky, jejichž molekuly mají tvar kruhu
- aromatické uhlovodíky, jejichž molekuly obsahují alespoň jeden šestičlenný kruh, tzv. benzenové jádro.
- Sloučeniny, které ve své molekule obsahují C, H a O, lze zhruba rozdělit do následujících skupin:
- alkoholy, obsahující skupinu C-OH
- fenoly, které skupinu -OH mají připojenu k aromatickému jádru
- ethery, obsahující skupinu C-O-C
- organické peroxidy, obsahující skupinu C-O-O-C
- aldehydy, obsahující skupinu HC=O
- ketony, obsahující skupinu C-CO-C
- karboxylové kyseliny, obsahující skupinu -COOH
- estery, obsahující skupinu R-C-OOR
- Další typy organických sloučenin, které ve své molekule obsahuji i dusík nebo síru, jsou uvedeny v heslech těchto prvků.
Výskyt a využití
Na Zemi i ve vesmíru je uhlík poměrně značně rozšířeným prvkem. V zemské kůře je jeho obsah uváděn s relativně vysokým rozptylem v rozmezí 200 - 800 ppm (mg/kg), obsah v mořské vodě činí 28 mg/l. Ve vesmíru připadá jeden atom uhlíku přibližně na 20 000 atomů vodíku.
Grafit
neboli tuha je nerost neboli minerál, který se vyskytuje v mnoha lokalitách na Zemi. Jedny z největších grafitových dolů se nalézají v USA (Texas a stát New York), Mexiku, Indii a Rusku; významná byla i ložiska v jižních Čechách. Grafit je např. zároveň složkou sazí, které vznikají spalováním fosilních paliv. Je přitom přítomen v částečkách natolik nepatrných rozměrů, že saze mají spíše vlastnosti amorfního uhlíku. Grafit se průmyslově využívá především při výrobě tužek. Přitom se nejprve velmi jemně namele společně s vápnem a vylisuje se do vhodného tvaru. Další významné uplatnění grafitu je v metalurgickém průmyslu. Vzhledem k jeho značné tepelné odolnosti se z něho vyrábějí nádoby, tzv. kokily, do kterých se odlévají roztavené kovy a jejich slitiny. Zamezí se tak kontaminaci slitiny kovem, ze kterého by se kokila musela vyrobit. Z grafitu se vyrábějí i elektrody pro elektrolytickou výrobu hliníku z taveniny směsi bauxitu a kryolitu nebo při výrobě křemíku z taveniny oxidu křemičitého. Z grafitu se kromě jiného vyrábějí kartáčky elektromotorů. Slouží také jako součást maziv (grafitová vazelína, kolomaz).
Skelný grafit
Uměle vyrobenou formou grafitu je tzv. skelný uhlík (angl. glassy carbon), který se vyznačuje vysokou hustotou, nízkou pórovitostí a značnou chemickou a mechanickou odolností. V praxi se vyrábí přesně řízeným dlouhodobým vysokoteplotním (pyrrolitickým) rozkladem organických látek na povrchu normálního grafitu. Díky mimořádným fyzikálním a chemický vlastnostem skelného grafitu se jeho praktické využití stále rozšiřuje i přes jeho poměrně vysokou cenu.
- Pro elektrochemii je důležitý fakt, že povrchy elektrod ze skelného grafitu jsou chemicky vysoce odolné a lze na nich dosáhnout vysokého kladného potenciálu, aniž by docházelo k jejich rozpuštění jako u normálních kovových elektrod. Toho lze využít jak v analytické chemii při zkoumání elektrochemických vlastností organických molekul tak pro preparativní oxidaci při výrobě některých sloučenin.
- Analytická metoda GFAAS (atomová absorpční spektrometrie s bezplamennou atomizací) používá pro odpaření analyzovaného vzorku kyvetu, která se během několika sekund zahřívá až na teploty kolem 3 000 °C. Pokrytí vnitřní plochy této kyvety skelným grafitem dramaticky zvyšuje její odolnost a prodlouží její použitelnost ve srovnání s klasickou grafitovou kyvetou.
- V metalurgii se pro čištění kovů na vysoké čistoty metodou zonálního tavení mohou uplatnit trubice pokryté sklelným grafitem, v nichž se tavení provádí.
- Laboratorní nádobí s povrchem ze skelného grafitu dosahuje stejné nebo i lepší chemické odolnosti jako nádobí z platiny nebo její slitiny s rhodiem.
Diamant
Představuje jeden z nejvzácnějších a nejdražších minerálů. Vyskytuje se v různých barevných modifikacích od takřka průhledné až po černou. Protože ke vzniku diamantu je zapotřebí obrovských tlaků a vysokých teplot, jsou nalézány především tam, kde žhavé magma z velkých hloubek vystoupilo na povrch a ztuhlo. Naleziště s nejkvalitnějšími diamanty leží hlavně v Africe – JAR, Namibie, Sierra Leone, dále v Brazílii, Rusku, Kanadě a Austrálii. Diamanty je v současné době možno vyrábět i průmyslově, i když produkty zdaleka nedosahují kvalit přírodních diamantů. Tzv. průmyslové diamanty se proto využívají především k osazování různých vrtných a řezných hlavic nástrojů, které pro svou činnost musí vykazovat mimořádnou tvrdost a odolnost. Přírodní diamanty slouží již od pradávna především k výrobě těch nejdražších šperků. Aby se mohl diamant zasadit do zlatého nebo platinového šperku, musí být nejprve složitě a pečlivě broušen. K úspěšnému vybroušení drahého a vzácného diamantu je třeba nejen značné zkušenosti, ale i zručnosti a trpělivosti. Středisky broušení diamantů a obchodu s nimi jsou belgické Antverpy a nizozemský Rotterdam a Amsterodam. Připojený obrázek ukazuje diamant Cullinan I, zvaný také Hvězda Afriky, o hmotnosti 530,20 karátů, který byl vybroušen v roce 1908 v Amsterodamu. Tento skvost je v současné době umístěn v Londýnském Toweru jako součást korunovačních klenotů britského panovnického dvora.
Fosilní paliva
Mezi základní fosilní paliva patří uhlí, ropa a zemní plyn. Všechna tato paliva obsahují jako převažující složku pestrou škálu organických sloučenin, které podle současných teorií vznikly dlouhodobým anaerobním rozkladem organické hmoty. V případě uhlí se zdá být prekursorem dřevo druho- a třetihorních pralesů, které byly zničeny nějakou náhlou katastrofou. Ropa a zemní plyn pocházejí pravděpodobně z živočišných tkání obyvatelů pravěkých moří, kteří byli při nějaké katastrofické události překryti vrstvou hornin a během milionů následujících let se postupně rozložili za vzniku pestré škály sloučenin na bázi uhlovodíků. Všechny výše uvedené komodity tvoří v současné době páteř světové energetiky a převážné části chemického průmyslu. Především ropa se v posledních letech jeví jako klíčová surovina pro současnou civilizaci. Je jednak základním zdrojem energie pro stále rostoucí dopravní infrastrukturu a zároveň je zřejmé, že její celosvětové zásoby mohou být vyčerpány v následujících několika dekádách. Ovládnutí lokalit s jejich převažujícím výskytem se v dalších několika desetiletích může stát zdrojem globálního konfliktu. Ropa i zemní plyn se vyskytují obvykle společně. V současné době se hlavním zdrojem této suroviny stala oblast v okolí Perského zálivu a Sibiře, ale nezanedbatelná množství ropy se těží i šelfových vodách Severního moře, v Mexickém zálivu a jihovýchodní Asie. Také naleziště v Texasu poskytují doposud poměrně silný zdroj, který však rozhodně nepostačuje pro potřeby ekonomiky USA. Světové zásoby uhlí jsou výrazně větší než ropy a zemního plynu. V současné době se využívá spíše jako zdroj pro výrobu elektrické energie. Principiálně jej lze přepracovat i na kapalné zdroje energie pro spalovací motory, ale problémem jsou mnohem vyšší náklady na těžbu i nutnost daleko komplikovanější a dražší cesty k získání požadovaných produktů – tedy především benzínu a motorové nafty. Kromě energetického využití nachází uhlí uplatnění v metalurgii, kde po přepracování na koks slouží jako redukční médium při výrobě železa a podobných kovů z oxidických rud ve vysoké peci.
Jantar
Jantar je zvláštní forma uhlíkatého minerálu. Jedná se o mineralizované zbytky třetihorních pryskyřic staré až 50 milionů let. Nalézá se v Evropě jako zkamenělá pryskyřice borovic a ve Střední Americe a Mexiku, kde jde o klovatinu tropické dřeviny kopálu.
Vápenec a další uhličitany
Čistý uhličitan vápenatý CaCO3 je znám jako nerost kalcit. Horniny na bázi uhličitanu vápenatého neboli vápence jsou biogenního původu, protože převážně vznikly z vápenatých schránek druhohorních mořských živočichů. Velká naleziště těchto hornin se na nacházejí v Čechách, v Itálii, Anglii a např. USA. Podle přítomných příměsí mají různou barvu od čistě bílé až po téměř černou i mechanické vlastnosti. Slouží proto jak k výrobě běžných stavebních surovin jako pálené vápno nebo cement, tak jako dekorační kámen (mramor). Vápenec je také základem tzv. krasových jevů, při kterých dochází systémem složitých rovnováh mezi uhličitany a hydrogenuhličitany vápníku ke vzniku nádherných přírodních úkazů především v jeskyních a podzemních prostorách. Uhličitan hořečnatý MgCO3 je nazýván magnezit a slouží především jako surovina pro výrobu žáruvzdorných materiálů pro výstavbu vysokých a cementářských pecí. Velká ložiska magnezitu se nacházejí na Slovensku, v Rakousku, Číně a Korei.
Oxid uhličitý
Oxid uhličitý CO2 je bezbarvý plyn, bez zápachu, který se rozpouští ve vodě za vzniku velmi slabé kyseliny uhličité. Tvoří přibližně 0,038% objemu zemské atmosféry, kam se dostává jednak dýcháním živých organizmů a v současnosti stále rostoucím tempem spalováním fosilních paliv. Z atmosféry odčerpávají oxid uhličitý rostliny procesem zvaným fotosyntéza, za pomoci organického barviva chlorofylu. Toto barvivo je schopno využít energie fotonu slunečního světla k nastartování poměrně značně komplikovaného řetězce chemických reakcí, jejich výsledek lze jednoduše popsat takto:
- 6 H2O + 6 CO2 + foton → C6H12O6 (glukóza) + 6 O2
Uvedená reakce je zcela klíčová pro veškerý pozemský život, protože za její pomoci se všem živým organizmům dostává energie, která nám umožňuje naší existenci a zároveň se takto vytváří kyslík, který je nezbytný pro dýchání Zvyšující se koncentrace oxidu uhličitého je s spojena s jevem zvaným skleníkový efekt, protože molekuly CO2 pohlcují intenzivně infračervené záření a zabraňují tak jeho vyzařování do kosmického prostoru. Tím dochází k postupnému zahřívání povrchu planety Země a mohlo by to vést např. k poměrně prudkému tání ledovců a pólech a následnému stoupnutí hladiny světových oceánů až o desítky metrů.
- V tisku se nyní objevila zpráva o zajímavém projektu na snížení skleníkového efektu umělým ukládáním pevného oxidu uhličitého do zemské kůry. Uvažovalo se o tom, že zkapalněný CO2 by byl pod vysokým tlakem vháněn do podloží, ze kterého je těžena ropa. Tím by se docílilo jednak téměř kompletního vytěžení ložiska a zároveň by se oxid uhličitý přeměnil na suchý led, který by měl v hornině zůstat po další tisíce let. Projekt je přitom zaměřen na podmořská ložiska ropy, protože tlak vody nad takto zaplněným ložiskem by zároveň zaručil udržení CO2 v pevném stavu prakticky po neomezeně dlouhou dobu.
V průmyslu má oxid uhličitý uplatnění např. jako inertní atmosféra při procesech, kde je nutno vyloučit přítomnost kyslíku. Protože oxid uhličitý nehoří, používá se i jako náplň některých typů hasicích přístrojů. Oxid uhličitý je obsažen v řadě nápojů; buď je jejich přirozenou složkou (alkoholové kvašení piva, šumivého vína, burčáku; minerální vody) nebo jsou jím syceny uměle pro zlepšení chuti (limonády, levnější perlivá vína, některé minerálky). Stlačením oxidu uhličitého vzniká pevná látka, tzv. suchý led, která snadno sublimuje, přičemž odebírá značné množství tepla z okolí a využívá se k chlazení např. v potravinářství.
Oxid uhelnatý
Oxid uhelnatý CO je vysoce toxický, vznětlivý až výbušný, bezbarvý plyn, bez zápachu, který vzniká především nedokonalou oxidací organických sloučenin uhlíku. Vyskytuje se především jako součást svítiplynu, kde vzniká tlakovým a tepelným rozkladem uhlí. Oxid uhelnatý vzniká vždy v jistém malém množství při spalování benzínu a ropy ve spalovacích motorech. Tím se stává významnou součástí tzv. suchého smogu losangelského typu. V posledních letech je tvorba CO při provozu spalovacích motorů potlačována použitím autokatalyzátorů, obvykle založených na kombinaci působení různých platinových kovů na spaliny o vysoké teplotě. Působením těchto katalyzátorů dochází k téměř 100% konverzi oxidu uhelnatého na oxid uhličitý. Jisté množství oxidu uhelnatého je přítomno i v cigaretovém kouři jako důsledek nedokonalého spalování tabáku. Mezi přírodní zdroje oxidu uhelnatého patří např. zemní plyn, kde je však přítomen pouze v nízkých koncentracích. Je složkou důlních plynů, kde spolu s metanem způsobuje jejich mimořádnou výbušnost, sám o sobě je příčinou jejich toxicity. Vysoká toxicita oxidu uhelnatého je dána jeho schopností blokovat dýchací řetězec. Molekula CO se přitom téměř irreversibilně naváže na atom železa přítomný v molekule hemoglobinu, která slouží jako přenašeč kyslíku. Tak dojde k zablokování přenosu kyslíku z plic do organizmu a udušení postiženého organizmu.
Izotopy uhlíku a radiokarbonová metoda datování
V přírodě se uhlík vyskytuje běžně ve formě dvou stabilních izotopů: 12C, který tvoří 98,9% a 13C s průměrným výskytem 1,1%. Reakcí atomů dusíku 14N, přítomných v atmosféře s kosmickým zářením vzniká nestabilní izotop 14C, který se rozpadá (beta rozpad) s poločasem 5 715 let. Poměr všech 3 izotopů uhlíku v atmosférickém oxidu uhličitém se tak dlouhodobě udržuje na konstantní hodnotě. Živé organizmy neustále korespondují s atmosférickým CO2 ať již formou fotosyntézy (rostliny) nebo příjmem jejich produktů – býložravci a následně predátoři. Lze proto tvrdit, že poměr 14C/12C zůstává v průběhu života daného organizmu konstantní. Po odumření jakékoliv biologické tkáně se výměna uhlíku mezi organizmem a prostředím zastaví. Zároveň nedochází ani ke vzniku 14C reakcí s kosmickými paprsky, protože ty jsou pohlceny atmosférou. Obsah 14C klesá podle zákonitostí rozpadu nestabilních atomových jader. Radiokarbonová metoda datování využívá zmíněného jevu tím způsobem, že v archeologickém či jiném nálezu pozůstatku živé hmoty (zbytky tkání, kosti, popel…) je analyzován poměr 14C/12C. Zjištěný poměr pak poměrně přesně ukazuje na dobu zániku dané živé hmoty. Vzhledem k uvedenému poločasu rozpadu uhlíku 14C je metoda optimálně použitelná pro objekty o stáří 2 – 100 tisíc let. Při hodnocení naměřených výsledků je třeba vzít v úvahu i možnost působení radioaktivních zářičů na zkoumaný materiál v průběhu jeho depozice na místě nálezu, protože tak může dojít k významnému zkreslení dat.
Poznámky
- ↑ Viz následující poznámka:
- ↑ V r. 2009 byly objeveny další dvě teoreticky předpovězené modifikace uhlíku obdobné diamantu a lonsdaleitu.[3][4] V meteoritu Haverö třídy ureilitů byly zjištěny mikrokrystaly (řádově 10 nm) romboedrické modifikace diamantu a tzv. polytypu 21R diamantu. Obě se vyznačují tvrdostí vyšší, než má diamant, což bylo prokázáno leštěním meteoritu pastou obsahující krystaly diamantu.
Literatura
- Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.:Analytická chemie, SNTL, Praha 1974
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood - A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
Reference
- ↑ http://www.beilstein-journals.org/bjoc/home/home.htm
- ↑ http://www.stn-international.com/index.php?id=123
- ↑ FERROIR, Tristan; DUBROVINSKY, Leonid, Ahmed El Goresy, Alexandre Simionovici, Tomoki Nakamura, Philippe Gillet Carbon polymorphism in shocked meteorites: Evidence for new natural ultrahard phases. Earth and Planetary Science Letters [online]. , 15. únor 2010, svazek 290, čís. 1-2 [cit. 2010-02-04], s. 150-154. Dostupné online. PDF: [1].ISSN 0012-821X. DOI:10.1016/j.epsl.2009.12.015. ( )
- ↑ Popularizační zpráva k předchozí referenci
Externí odkazy
- Periodická soustava a tabulka vlastností prvků [2]
- Chemický vzdělávací portál [3]
- WebElements (anglicky) [4]
- Periodická tabulka prvků [5]
|
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |