Multimediaexpo.cz je již 18 let na českém internetu !!
Kyslík
Z Multimediaexpo.cz
m (Nahrazení textu) |
m (1 revizi) |
Verze z 8. 2. 2014, 22:59
| Kyslík | |

| |
| Atomové číslo | 8 |
| Stabilní izotopy | 16,17,18 |
| Relativní atomová hmotnost | 15,9994 amu |
| Elektronová konfigurace | 1s2 2s2 2p4 |
| Skupenství | Plynné |
| Teplota tání | −218,79 °C (54,36 K) |
| Teplota varu | −182,95 °C (90,20 K) |
| Elektronegativita (Pauling) | 3,44 |
| Hustota | 1,429 kg/m³ (0 °C, 101,325 kPa) |
Kyslík chemická značka O, (lat. Oxygenium) je plynný chemický prvek, tvořící druhou hlavní složku zemské atmosféry. Je biogenním prvkem a jeho přítomnost je nezbytná pro existenci většiny živých organizmů na této planetě. Autorem jeho českého a slovenského názvu je Jan Svatopluk Presl.
Obsah |
Historie výzkumu kyslíku [1]
- 15. století – Leonardo da Vinci sledoval vlastnosti vzduchu. Určil, že jedna z jeho složek podporuje hoření.
- 1608 – Cornelius Drebbel navrhl výrobu kyslíku zahřátím sanytru (ledku).
- 1772 – Carl Wilhelm Scheele objevil kyslík a pojmenoval ho "ohnivý vzduch". Objev byl však publikován až v roce 1777.
- 1774 – Joseph Priestly objevuje kyslík dva roky nezávisle po Scheeleovi. Publikuje však svůj objev jako první.
- 1779 – Antoine Lavoisier navrhuje název „oxygen“ (kyselinu tvořící) pro „dýchatelnou“ část vzduchu, která se účastní hoření.
- 1781 – Henry Cavendish zjišťuje, že voda je sloučeninou kyslíku a vodíku.
- 1785 – Van Marun popisuje pach kyslíku, mylně ho však přisuzuje unikátní formě kyslíku.
- 1840 – Christian Schönbein objevuje ozón, díky charakteristickému zápachu při používání elektrických přístrojů ve špatně větrané laboratoři.
- 1858 – Werner von Siemens konstruuje první přístroj, který využívá tichého elektrického výboje k výrobě ozónu.
- 1861 – William Odling navrhuje vzorec O3 pro ozón po reakci ozónu s iodidem draselným.
- 1868 – J.L. Soret potvrdil vzorec ozonu O3 difůzními studiemi.
- 1877 – Kyslík byl poprvé zkapalněn nezávisle L. Cailletetem a R. Picketem.
- 1882 – J.W. Strutt objevuje, že atomová hmotnost kyslíku není přesně 16,00 , ale 15,872.
Základní fyzikálně – chemické vlastnosti
Kyslík je velmi reaktivní permanentní plyn, nezbytný pro existenci života na naší planetě. Slučování kyslíku s ostatními prvky se nazývá hoření, pokud je látka zahřáta na zápalnou teplotu. Jde prakticky vždy o exotermní reakci, která vede k uvolnění značného množství tepelné a světelné energie. Produkty hoření se nazývají oxidy, dříve kysličníky.
Výskyt v přírodě
Na Zemi je kyslík velmi rozšířeným prvkem.
- V atmosféře tvoří plynný kyslík 21 objemových %.
- Voda oceánů, které pokrývají 2/3 zemského povrchu je hmotnostně složena z 90 % kyslíku.
- V zemské kůře je kyslík majoritním prvkem, je přítomen téměř ve všech horninách. Jeho obsah je odhadován na 46 – 50 hmotnostních %. V hlubších vrstvách zemského tělesa zastoupení kyslíku klesá a předpokládá se, že v zemském jádře je přítomen pouze ve stopách.
Ve vesmíru je zastoupení kyslíku podstatně nižší. Na 1 000 atomů vodíku zde připadá pouze jeden atom kyslíku.
Anorganické sloučeniny
Ve svých sloučeninách se kyslík vyskytuje převážně v mocenství O-II, výjimečně pak jako O-I a O+Ia také O-I/II v superoxidech(KO2- superoxid draselný). Záporně dvojmocný kyslík je přítomen ve velmi široké škále sloučenin. Především jsou to oxidy, vlastnosti jednotlivých sloučenin jsou detailněji popsány v kapitolách příslušných jednotlivým prvkům. Kyslík je přítomen ve většině anorganických kyselin a jejich solí. Z těch nejdůležitějších je možno jmenovat uhličitany (CO3)-II, křemičitany (SiO3)-II, sírany (SO4)-II, dusičnany (NO3)- a fosforečnany (PO4)-III. Alkalické sloučeny hydroxidy se vyznačují přítomnosti skupiny -OH. Mezi nejznámější patří hydroxid (louh) sodný NaOH, draselný KOH a vápenatý, hašené vápno Ca(OH)2.
Ve valenci O-I vystupuje kyslík v peroxidech, nejznámější z nich je bezesporu peroxid vodíku H2O2. Tato kapalná sloučenina má silné oxidační účinky a v praxi se používá ve formě svých vodných roztoků v medicíně pro desinfekci a v chemii jako oxidační činidlo. Peroxid sodný Na2O2 je pevná, hygroskopická látka, která nachází uplatnění jako velmi energetické oxidační činidlo. Pouze fluor vykazuje větší elektronegativitu než kyslík a tvoří s ním několik fluoridů, v nichž se kyslík vyskytuje v mocenství O+I i O+II. Všechny fluoridy kyslíku jsou značně nestálé, přesto však existuje reálná možnost jejich využití jako raketového paliva.
Organické sloučeniny
Kyslík se vyskytuje ve velkém množství organických látek. Řada těchto sloučenin je součástí všech živých organismů, protože kyslík patří mezi základní biogenní prvky. Základní skupiny organických sloučenin s obsahem kyslíku jsou:
- alkoholy, obsahující skupinu C-OH
- fenoly, které skupinu -OH mají připojenu k aromatickému jádru
- ethery, obsahující skupinu C-O-C
- peroxidy,obsahující skupinu C-O-O-C
- aldehydy,obsahující skupinu HC=O
- ketony, obsahující skupinu C-CO-C
- karboxylové kyseliny, obsahující skupinu -COOH
- estery,obsahující skupinu R-C-OOR
- z heterocyklických sloučenin je možno uvést např. furan:

Využití atmosférického kyslíku
Jedná se o neviditelnou složku prakticky každého fosilního paliva obsaženou v ovzduší (technologická oxidace fosilních paliv)
- výroba elektrické energie - spalování fosilních paliv v tepelných elekrárnách (často v kombinaci s výrobou technologického tepla)
- výroba technologického tepla - spalování fosilních paliv v teplárnách (často v kombinaci s výrobou elektrické energie)
- pohon motorů a turbín - ve všech druzích spalovacích motorů a turbín
- vytápění domácností v domovních kotelnách, kamnech či v krbech
- příprava pokrmů (kupř. plynové sporáky)
- nouzové osvětlování (kupř. svíčky, petrolejové lampy)
Poznámka : nežádoucí chemicko technologický či fyzikálně chemický proces - koroze kovů způsobená nežádoucí oxidací kovů a dalšími doprovodnými chemickými reakcemi
Výroba a využití
Kyslík se prakticky výlučně vyrábí destilací zkapalněného vzduchu. Vyrobený kyslík se uchovává buď ve zkapalněném stavu ve speciálních Dewarových nádobách (viz obrázek) nebo plynný v ocelových tlakových lahvích. Vzhledem k vysoké reaktivitě čistého kyslíku je nezbytné, aby se nedostal do přímého kontaktu s organickými látkami. Proto se všechny součásti aparatury pro uchovávání a manipulaci s kapalným nebo stlačeným kyslíkem nesmí mazat žádnými organickými tuky nebo oleji.
- V medicíně se čistý kyslík používá při operacích a traumatických stavech pro podporu pacientova dýchání. Směsi kyslíku nebo vzduchu s inertními plyny slouží potápěčům k potlačení kesonové nemoci při ponorech do velkých hloubek.
- Také vysokohorští horolezci a letci se v nutných případech uchylují k dýchání čistého kyslíku. I piloti stíhacích letadel jsou vybaveni směsmi stlačených plynů, jejichž základní složkou je kyslík. To proto, že zvýšením koncentrace kyslíku se zvýší jeho parciální tlak a ulehčí se tak dýchání v řídké atmosféře a předejde vysokohorské nemoci.
- Američtí astronauti programu Apollo dýchali také atmosféru čistého kyslíku, což umožnilo snížit tlak v kabině zhruba na třetinu běžné hodnoty a tak odlehčit její hermetickou konstrukci. To se ale stalo osudným posádce Apolla 1, která ve vysoce hořlavé atmosféře uhořela.
- Při hoření směsi kyslíku s acetylenem lze dosáhnout teploty cca 3 150 - 3 200 °C. Proto se kyslíko-acetylenový plamen využívá k řezání oceli a tavení kovů s vysokým bodem tání, např. platinových kovů.
- Při výrobě oceli je nutné především odstranit z matrice železa uhlík. Tzv. Bessemerův způsob výroby spočívá ve vhánění čistého kyslíku do roztaveného železa v konvertoru, kde za vysoké teploty taveniny dochází k oxidaci přítomného grafitického uhlíku na plynné oxidy, které z taveniny vytěkají.
- Kapalný kyslík většinou slouží jako okysličovadlo raketových motorů při letech kosmických lodí.
- Kyslík se používá jako jedna ze složek pro náplň některých typů palivových článků
Ozon
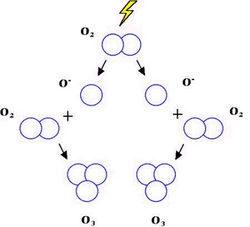
Kromě obvyklých dvouatomových molekul O2 se kyslík vyskytuje i ve formě tříatomové molekuly jako ozon O3. Za normálních podmínek je to vysoce reaktivní plyn modré barvy a charakteristického zápachu s mimořádně silnými oxidačními účinky. Při teplotě -112 °C kondenzuje na kapalný tmavě modrý ozon a při -193 °C se tvoří červenofialový pevný ozon.
Výroba a využití
2H2O2 → O2+2H2O Poměrně snadno lze připravit ozon tichým elektrickým výbojem v atmosféře čistého kyslíku. Vzniká tak směs kyslíku s ozonem, kde podíl O3 dosahuje obvykle 10%. Čistý ozon lze pak připravit frakční destilací této plynné směsi. Praktické využití ozonu je dáno jeho silnými oxidačními účinky.
- V medicíně slouží ke sterilizaci nástrojů. Poněkud diskutabilní jsou účinky dnes poměrně populární ozonové terapie, která by podle svých zastánců měla vést k regeneraci buněk a tkání. Odpůrci této metody poukazují na možná rizika podobných omlazovacích kůr, daná především vysokou reaktivitou i toxicitou ozonu.
- Baktericidní účinky ozonu se někdy využívají k dezinfekci pitné vody namísto plynného chloru, chlornanů, chloraminu nebo oxidu chloričitého, případně jako první fáze před použitím uvedených látek (tzv. preozonizace). Výhodou je, že i při malých dávkách inaktivuje i parazitické prvoky, a také že oxiduje organické látky, aniž by docházelo k tvorbě karcinogenních trihalomethanů.[2]
- Silné oxidační účinky ozonu se velmi často využívají v papírenském průmyslu k bělení celulózy pro výrobu papíru.
Ozonová vrstva
Mimořádně významnou roli pro pozemský život hraje tzv. ozonová vrstva atmosféry, která chrání planetu před ultrafialovým slunečním zářením. Je to část stratosféry ve výšce 25 – 35 km nad zemským povrchem, v níž se nachází značně zvýšený poměr ozonu vůči běžnému dvouatomovému kyslíku.
Troposférický ozon
Opakem životu prospěšného ozonu ve stratosféře je tzv. přízemní neboli troposférický ozon, vyskytující se těsně nad zemským povrchem. Tento plyn je lidskému zdraví nebezpečný, působí dráždění a nemoci dýchacích cest, zvyšuje riziko astmatických záchvatů, podráždění očí a bolest hlavy. Zvýšený vznik přízemního ozonu pozorujeme především za slunečných horkých letních dnů v lokalitách s vysokou koncentrací výfukových plynů - oxidů dusíku a těkavých organických látek v ovzduší. Tento jev se souhrnným názvem označuje jako suchý smog, někdy také fotochemický smog nebo losangelský smog (podle místa častého výskytu). V Evropské unii je podle Evropské agentury pro životní prostředí nadlimitním koncentracím ozónu vystaveno 6 z 10 obyvatel evropských měst. V rozsáhlých oblastech střední a jižní Evropy koncentrace překračují kritické hodnoty pro negativní účinek na lesy a zemědělské plodiny.[3]
Elektronová konfigurace: 1s2, 2s2, 2p4.
Související články
Literatura
- Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.:Analytická chemie, SNTL, Praha 1974
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood - A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
Reference
- ↑ Greenwood, N. N. - Earnshaw, A.: Chemie prvků. 1993.
- ↑ Doc. RNDr. Jiří Dřímal: Ozon v moderních technologiích úpravy pitné vody
- ↑ Miroslav Šuta:Český vzduch? Jeden z nejšpinavějších v Evropě, respekt.cz, 14. listopadu 2007
Externí odkazy
- Periodická soustava a tabulka vlastností prvků [1]
- Chemický vzdělávací portál [2]
- WebElements (anglicky) [3]
- Periodická tabulka prvků [4]
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |